Как работает аккумулятор
Как работает аккумулятор
В аккумуляторах в качестве электролита используют раствор серной кислоты (кислотные аккумуляторы с положительным электродом из диоксида свинца и отрицательным — из губчатого свинца) и раствор гидроксида калия (щелочные аккумуляторы систем гидроксида никель-железа, гидроксида никель-кадмия и др.). Их ассортимент подразделяется по числу элементов, емкости, напряжению и по форме.
Номинальная емкость аккумулятора (А*ч) — количество электричества, которое он может отдать при разряде до определенного снижения напряжения. На количество циклов и емкость аккумулятора влияют характер подключения нагрузки (непрерывный, переменный или импульсный), отбираемая мощность (максимальная, средняя, минимальная), режим заряда (нормальный, ускоренный, быстрый/форсированный), постоянный режим подзаряда. Зарядные и разрядные характеристики определяют время стандартного или быстрого заряда и допустимые при этом напряжение и токи. При стандартном времени заряда емкость аккумулятора больше, чем при быстром, что позволяет обеспечить большие разрядные токи и время работы. При импульсной (повторно-кратковременной) нагрузке, когда время рабочего цикла меньше следующей за ним паузы, величина разрядного тока может быть в несколько раз больше, чем при обычном разряде. Учитывая эти обстоятельства, выпускаются отдельные группы аккумуляторов с одним профилирующим параметром. В конструкции аккумуляторов в виде элементов или батарей предусмотрено наличие встроенного или автономного зарядного устройства. .
В бытовой радиоэлектронной аппаратуре широко применяются никель-кадмиевые аккумуляторы. По сравнению с кислотными аккумуляторами щелочные аккумуляторы лучше переносят тряску, короткие замыкания и при равных электрических показателях в три раза легче.
Кислотные аккумуляторы отличаются большой емкостью, способностъю подзаряжаться от генератора во время использования, значительным током разряда. В то же время они способны терять свои свойства при хранении и несвоевременной зарядке. Их применяют в автомобилях, например для питания термоэлектрических холодильников. За последние годы конструкция кислотных аккумуляторов существенно изменилась.
Появились необслуживаемые или малообслуживаемые аккумуляторы. обеспечена иммобилизация («неподвижность») электролита, выпушены герметизированные модели, улучшена работа в буферных режимах со сроком службы до 25 лет и увеличением ресурса до 800 циклов. Сформирована единая стандартизация кислотных аккумуляторов.
К преимуществам литиевых аккумуляторов относятся высокое рабочее напряжение 3,6 В, малые габаритные размеры, наличие встроенных микропроцессорных устройств в зарядных системах.
Для удобства потребителей в конструкции химических источников тока (например, алкалические элементы Duracell, Energizer) предусмотрены электрохимические индикаторы, позволяющие оценить величину электрической энергии по интенсивности окраски полосы тестера, появлению надписей или др.
По оценке экспертов, на рынке химических источников тока представлены 24 отечественные и 71 зарубежная торговые марки. На упаковке качественных ХИТ (прозрачная полимерная потребительская тара (блистер), наклеенная на картонную основу, содержащую 1-4 элементов) должны быть указаны страна — производитель товара; название торговой марки со знаком регистрации, например Duracell R; адрес фирмы и ее представительства в России; срок годности; сертификат соответствия; типоразмер по 2-4 стандартам (например ANSI, DIN, NEDA); краткие рекомендации по эксплуатации. Кроме блистеров для упаковки батареек используют прозрачную термоусадочную пленку, или пленку в виде мешочка (у батареек напряжением 9 В), и коробки для батареек на 24 шт., не имеющих или имеющих индивидуальную упаковку. Кроме обязательной информации, производитель указывает особые свойства источника тока, как правило, на английском языке (Extra Power, Heavy Duly, Super Heavy Duty, Nothing Last Longer, 0%, Mercury — без ртути).
Как работают батарейки и аккумуляторы?

Где бы вы ни были и куда бы ни пошли, вы, так или иначе, столкнетесь с батарейками или аккумуляторами. Попробуйте представить мир, в котором бы все электроприборы питались от розеток – никаких телефонов, фонариков, ноутбуков, автомобилей и прочих уже привычных благ цивилизации. Аккумуляторы повсюду: от мобильных телефонов до космических кораблей. О том, как работают эти портативные источники энергии, из чего они сделаны, и какие мифы о них правдивы, а какие – нет, мы попытаемся разобраться в этой статье.
Первые батарейки
Считается, что примитивными батарейками пользовались еще арабы во времена до нашей эры. В результате раскопок под Багдадом археологи нашли глиняные кувшины, в которых находились железные стержни в медной оболочке. Протестировав находки в лаборатории, ученые пришли к выводу, что кувшины были наполнены кислотной жидкостью, скорее всего, вином или уксусом. Для каких целей использовались подобные устройства не совсем понятно, т.к. представление об электричестве возникло спустя практически два тысячелетия, но факт остается фактом: батарейками пользовались еще до Рождества Христова.
Первый в истории стабильный химический источник питания. Автор: dpantalony
Однако первые современные батарейки появились в 1800 году благодаря итальянскому ученому Алессандро Вольте, который получил непрерывный электрический ток, поместив цинковые и медные пластины в кислоту. Это изобретение получило название Вольтов столб, а единица измерения напряжения получила название в честь его создателя. С тех пор появились новые виды батареек с усовершенствованной конструкцией и улучшенным коэффициентом полезного действия, но принцип их работы существенно не изменился: при подключении батарейки к устройству в ней происходит электрохимическая реакция и вырабатывается электричество.
По типу электрохимической реакции различают два типа химических источников питания: 1. Гальванические элементы (батарейки). Они отличаются необратимой реакцией при выработке электроэнергии, поэтому их нельзя перезарядить. Попытка перезарядить батарейку может привести к утечке щелочи или другого вещества, в зависимости от батарейки. 2. Аккумуляторы. Они отличаются обратимостью реакций при выработке электричества, поэтому их можно перезарядить. Аккумуляторы могут не только, как батарейки, преобразовывать химическую энергию в электрическую, но и наоборот.
Как работают батарейки
Оригинал: Microsoft Encarta
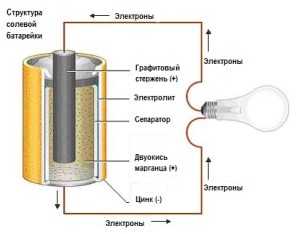
Главными компонентами батарейки, из которых она состоит на 90 %, являются электролит и два электрода: анод, подключенный к отрицательному полюсу (-) и катод, подключенный к положительному полюсу (+). Если подключить батарейку к электрической цепи, в ней начнут происходить окислительно-восстановительные процессы. Взаимодействуя с электролитом, материал анода начнет окисляться и выделять отрицательно заряженные частицы – электроны, – которые и образуют электрический ток. Во время работы батарейки в аноде (-) вырабатывается избыточное количество электронов, и единственным выходом для них является перемещение к положительному полюсу. Взаимодействуя с материалом катода, электроны нейтрализуются в результате реакции восстановления. Именно избыток электронов в отрицательном полюсе и их нехватка в положительном полюсе приводит к постоянному перераспределению электронов между полюсами и создает электрическое напряжение. Окислительно-восстановительные процессы протекают в батарейке постоянно, пока она подключена к электрической цепи, изменяя изначальный состав материалов анода и катода: образуются второстепенные элементы, которые препятствуют движению электронов. Это приводит батарейку в негодность.
Аккумуляторы
Аккумуляторы отличаются от батареек обратимостью химических процессов, проще говоря, возможностью перезарядки. В электрической цепи аккумулятор работает так же, как и батарейка: в аноде образуются электроны, которые перемещаются в катод, образуя электрическое напряжение. Когда материал анода истощается, электроны прекращают вырабатываться и аккумулятор садится. Вот здесь и кроется главное преимущество аккумуляторы: в отличие от батарейки, анод можно восстановить, пропустив через аккумулятор электрический ток. Естественно, это не значит, что аккумуляторы будут работать вечно, ведь материал анода в любом случае будет постепенно истощаться, но на сотню перезарядок обычного аккумулятора зачастую хватает.
В зависимости от материалов, используемых в качестве анода и катода, выделяют разные типы батареек. Каждый тип отличается производительностью, сроком эксплуатации, ценой и вредностью. К сожалению, не существует идеальных батареек, которые бы удовлетворяли пользователей всеми параметрами. О типах батареек и аккумуляторов, их преимуществах и недостатках читайте далее.
Как работает аккумулятор автомобиля
Главная » Разное » Как работает аккумулятор автомобиля
Недавно я писал статью – сколько по времени заряжать аккумулятор, вам статья понравилась много положительных отзывов (за что вам спасибо), лайков и просмотров. Как обычно это бывает, посыпалось много дополнительных вопросов и особенно много от новичков. Многие задают – а как вообще работает батарея автомобиля? Какой принцип действия и для чего она вообще нужна? Конечно, вопросов гораздо больше (я их ВСЕ постараюсь осветить немного позже), но первым отвечу новичкам, причем эта информация как я считаю ключевая – дает понимание об электропитании машины. Опять же расскажу простым и доступным языком, так что читайте …

СОДЕРЖАНИЕ СТАТЬИ
Что и говорить, аккумулятор (иногда буду сокращать АКБ – аккумуляторная батарея) это электрическое сердце наших авто. Сейчас с компьютеризацией машин его роль становится все значимее. Однако если вспомнить основные функции, то их можно выделить всего три:
- При выключенном состоянии питание электрических цепей нужных для авто, например бортовой компьютер, сигнализация, часы, настройки (как приборной панели, так, даже и сидений, ведь они на многих иномарках регулируются электричеством).
- Запуск двигателя. Основная задача – без батареи вы не запустите мотор.
- При больших нагрузках, когда генератор не справляется, подключается аккумулятор и отдает накопившуюся в нем энергию (но такое бывает крайне редко), если только генератор уже на последнем вздохе.

С функциями определились – теперь давайте вспомним устройство, как и из чего он состоит.
Устройство аккумулятора автомобиля
Знаете, первая свинцовая батарея появилась еще в 1859 году (изобрел француз Гастон Плантэ). И за свои полторы сотни лет она мало в чем изменилась. Правда, для аккумулятора машины используют несколько подключенных последовательно элементов.
ИТАК: Автомобильная батарея (АКБ) обычно состоит из 6 последовательно подключенных элементов. Каждый элемент считается независимым, то есть если его отключить он будет работать автономно – выдавая примерно 2,1 — 2,2В. Если представить одну ячейку в разрезе это будет – плоская и прямоугольная, герметичная «банка» — именно так ее называют. Как вы догадались если 2,1В умножить на «6», то получится 6 Х 2,1 = 12,6В, это нормальное общее напряжение в заряженном состоянии.


В каждую «банку» помещены свинцовые пластины и залит специальный электролит (основанной на серной кислоте). Пластины разбиты по отдельным группам – плюсовые и минусовые. Они не примыкают друг к другу, хотя и находятся рядом, между ними проложены диэлектрические элементы — обычно это пластиковые или прорезиненные листы. Если минусовые и плюсовые пластины соприкоснуться, то батарея работать не будет – банка замкнет. Делаются пластины из свинца:
Минусовые – обычно из чистого, но пористого свинца (Pb)
Плюсовые – делаются из диоксида свинца (PbO2)
Серная кислота, в которую они погружены, является очень хорошим проводником – по-научному электролитом, она способствует накоплению энергии.
Смысл прост — если подать на аккумулятор электрический ток, он начнет его накапливать. Затем через какое-то время (обязательно читаем вот эту статью), он будет его отдавать.
Есть еще такое понятие как емкость аккумулятора – она зависит от количества свинца использованного при производстве – чем больше – тем больше энергии можно накопить. Измеряется в Ампер/часах (Ам/ч) — это количество Ампер, которые отдаст аккумулятор за час. Сейчас самые распространенные варианты – это 55 – 60 Ам/ч, которые применяются на большинстве легковых машин.
Как видите устройство банальное и простое, свинец + кислота, заключенные в герметичный пластиковый корпус (пластиковый потому что не вступает в реакцию с кислотой). При большом желании, можно сделать дома – если есть свинец и кислота.
НУ что же переходим к работе на автомобиле.
Работа АКБ на машине
Чтобы запустить двигатель его нужно «раскрутить» и подать искру на сжатое топливо. Крутит двигатель такое устройство как стартер, а генерируют искру катушки зажигания, после чего она идет на свечи. И для того и для другого действия нужен электрический ток – его то и дает аккумулятор автомобиля, это его самая главная задача, запомните запуск двигателя, все остальное второстепенно.

Как это происходит – при помощи химической реакции внутри батареи вырабатывается электрический ток. Вы садитесь и поворачиваете ключ зажигания – сразу же на генератор подается энергия, бендикс входит в зацепление с маховиком двигателя и начинает вращаться – к маховику подсоединен коленвал, который в свою очередь начинает толкать поршни – далее в высшей точке (сжатие) – происходит подача искры (опять же от аккумулятора) – топливо поджигается и двигатель запускается.
После от генератора начинает идти зарядка, которая восполняет (заряжает) потерю энергии аккумулятора.
Что еще хочется отметить – при разряде батареи на пластинах начинает образовываться сульфат свинца (по сути его соль), это нормально, обычная химическая реакция, чем больше отдается энергии, тем больше этого налета. Чем больше соли, тем менее концентрированный электролит, падает выработка энергии.
Но стоит вам подключить АКБ на зарядку, то процесс идет в обратном направлении – соли начинают растворяться в электролите, концентрация восстанавливается, что способствует накоплению энергии. После зарядки выработка электрического тока восстанавливается.
Почему батарея автомобиля может выйти из строя?
Как не прискорбно — нет ничего вечного, вот и АКБ со временем изнашивается. Конечно, если вы его используете правильно, то он прослужит достаточно долго, но уже через 4 – 5 лет (иногда 6), нужна замена. Так почему же умирает батарея?
Все просто – основная причина это глубокий разряд, если разрядить – совсем, да еще и долго не заряжать то пластины покрываются солями гораздо плотнее. Их рабочая поверхность падает, а соответственно будет падать и емкость аккумулятора, он уже не сможет выдерживать большие нагрузки.
Вторая причина это банально износ. Со временем от множества циклов заряда – разряда, пластины начинают медленно осыпаться. Что также ведет к деградации батареи. Особенно сильно страдают, если испарился электролит и пластина осталась «сухой» (часто это происходит летом при высоких температурах), если будет идти зарядка, то это очень быстро «убьет» аккумулятор. Вот почему в случае с обслуживаемым аккумулятором нужно всегда проверять уровень электролита.
Для того чтобы АКБ работал долго, нужно держаться двух правил – всегда держать его заряженным, а также не давать электролиту испариться из банок. Справедливости ради стоит отметить, что сейчас большинство аккумуляторов являются герметичными (запаянными), то есть электролит не может испариться, это немного облегчает задачу. Но за зарядом глаз да глаз.
Вот такая вот статья получилась, сейчас видео, для тех, кто не хочет читать — смотрим.
Думаю статья была вам полезна и вы теперь понимаете как работает АКБ в машине. НА этом заканчиваю, искренне ваш АВТОБЛОГГЕР.
avto-blogger.ru
Устройство, схема и принцип работы автомобильного аккумулятора

В своей хозяйственной деятельности человек использует различные устройства, в составе которых работают аккумуляторы. Это касается бытовой техники, мобильных устройств, часов, автомобилей, электроинструмента и много чего ещё. Вне зависимости от того, в какой сфере используются аккумуляторные батареи, принцип работы у них одинаков. В процессе зарядки АКБ накапливает электрическую энергию, а затем отдаёт для питания устройства. На сегодняшний день имеется много видов аккумуляторных батарей, у каждого из которых есть свои особенности в устройстве и функционировании. В этой статье мы поговорим про устройство автомобильного аккумулятора и его конструкцию.
Назначение АКБ в автомобиле
Аккумулятор представляет собой один из ключевых элементов авто. Работая в бортовой сети автомобиля в связке генератором, он является источником электрического тока. Основные функции аккумуляторной батареи заключаются в следующем:
- Обеспечение пуска мотора. Аккумулятор подаёт питание на стартер в момент запуска;
- Обеспечение питания потребителей в сети автомобиля, когда мотор заглушён;
- Обеспечивает питание во время поездки, если генератор перегружен.
Кроме того, при работе вместе с генератором АКБ осуществляет сглаживание пульсаций электрического тока в бортовой сети.

Напряжение аккумуляторных батарей для легковых автомобилей составляет 12 вольт. Ёмкость может лежать в пределах 40─130 Ач. Пусковой ток 300─1300 ампер. Значения справедливы для АКБ легковых машин и лёгкого коммерческого транспорта.
На грузовые авто и специальную технику могут устанавливаться батареи с напряжением 24 вольта. На мотоциклетной технике используются модели номиналом 6 вольт.
К аккумулятору для автомобиля обычно предъявляют следующие требования:
- небольшой саморазряд;
- высокий пусковой ток;
- компактные габариты;
- отсутствие или минимум обслуживания.
Дополнительно можете прочитать материал про виды аккумуляторов для автомобилей. Вернуться к содержанию
Устройство аккумулятора автомобиля
Из чего состоит аккумулятор автомобиля
В подавляющем большинстве легковых автомобилей работают свинцово-кислотные батареи с жидким электролитом (WET). Их устройство и конструкция постоянно дорабатывается и совершенствуется. Кроме того, ведутся разработки новых типов автомобильных аккумуляторов. Ниже представлена схема автомобильного аккумулятора.
Из чего состоит аккумулятор автомобиля
АКБ состоит из 6 банок (аккумуляторных элементов), подключённых последовательно. Все они заключены в пластиковый корпус, который не проводит электрический ток и стойкий к воздействию серной кислоты. В каждой банке есть набор положительных и отрицательных электродов, которые чередуются. Электрод представляет собой токоотводящую решётку, на которую нанесена обмазка (активная масса).Для того чтобы предотвратить замыкание электродов разной полярности, они помещены в полиэтиленовые сепараторы. Электроды выполнены из свинца с различными легирующими добавками. Устройство современных АКБ часто подразумевает наличие электродов из сплава свинца с кальцием. Это позволяет снизить саморазряд и расход воды. Примером могут служить необслуживаемые аккумуляторные батареи для автомобиля.
Вообще, можно выделить следующие актуальные разновидности WET аккумуляторов:
- Малосурьмянистые (малообслуживаемые). Положительные и отрицательные электроды выполнены из сплава свинца с сурьмой (до 6%);
- Кальциевые (необслуживаемые). Электроды выполнены из сплава свинца с кальцием;
- Гибридные. Отрицательный электрод выполняется из свинца, легированного кальцием, а положительный ─ сурьмой.
Существуют также разные методы изготовления решёток электродов (литьё, просечка) и нанесения активной массы. Некоторые производители имеют свои запатентованные технологии. В основном все они ориентированы на улучшение отвода тока и уменьшение внутреннего сопротивления АКБ. В некоторых случаях в состав электродов добавляют серебро, тантал, олово для того, чтобы увеличить стойкость к коррозии.
В современном производстве при выпуске положительных электродов применяют несколько методов:
- Power Frame. Это наиболее современная технология. В этом случае решётка электрода выполняется с опорной рамкой и внутренними направляющими. В результате повышается жёсткость конструкции;
- Power Pass. Эта технология подразумевает наличие вертикальных направляющий к «уху» электрода;
- Chess Plate. В этом случае направляющие располагаются в шахматном порядке.
На решётки электродов наносится обмазка или активная масса для увеличения поверхности взаимодействия с электролитом. Для положительных пластин используется диоксид свинца, а для отрицательных ─ губчатый свинец.
Устройство аккумулятора подразумевает погружение электродов в электролит. Это раствор серной кислоты в дистиллированной воде. Главной характеристикой электролита является его плотность. Эта величина изменяется в зависимости от степени заряда. Плотность максимальна на полностью заряженной АКБ и минимальна на разряженной.
Вернуться к содержанию
Особенности конструкции разных видов автомобильных аккумуляторов
Кроме аккумуляторов WET с жидким электролитом, есть и другие виды свинцово-кислотных аккумуляторов. Это батареи AGM и GEL. Их устройство предусматривает наличие кислотного электролита в связанном состоянии. Часто эти батареи обобщённо называют гелевыми, но это не совсем так. В AGM аккумуляторах электролитом пропитан материал из стекловолокна, который прилегает к свинцовым пластинам. На изображении ниже можно посмотреть устройство AGM аккумулятора.

Схема AGM батареи
Ещё одна разновидность свинцовых аккумуляторов называется GEL. Здесь кислотный электролит находится в гелеобразном состоянии. Это достигается за счёт добавления в кислоту оксида кремния. Этот вид АКБ практически не используется в легковых автомобилях. Батареи GEL можно встретить в мотоциклетной технике, скутерах, морском транспорте, домах на колёсах. А вот AGM батареи получают всё большее распространение в авто.
Популярность AGM растёт благодаря появлению автомобилей с системами старт-стоп и рекуперации энергии торможения. Требования к АКБ возрастают. От них требуется более высокий ток прокрутки, устойчивость к глубоким разрядам, длительный срок службы. Аккумуляторы AGM (расшифровывается, как Absorbed Glass Material) удовлетворяют требованиям современных автомобилей с большим количеством электроники на борту.
В продаже также можно встретить аккумуляторные батареи EFB или Enhanced Flooded Battery. По устройству эти АКБ можно отнести к WET батареям. Но в реальности они занимают промежуточную ступень между обычными WET и AGM аккумуляторами. В них залит жидкий кислотный электролит, а электроды имеют покрытие из микроволокна. Это обеспечивает большую аккумуляцию энергии, повышение токоотдачи и устойчивость к частым циклам заряд-разряд. Производители также рекомендуют использовать их в автомобилях с системами старт-стоп. Пока EFB и AGM не стали массовыми из-за высокой стоимости. Поэтому в большинстве машин используются аккумуляторы типа WET.
Стоит отметить, что при заряде АКБ идёт выделение газов. Поэтому корпуса аккумуляторов имеют систему отведения газов. Чтобы батарея оставалась герметичной используются предохранительные клапаны. Такие клапаны могут быть встроены в пробки. Их устройство позволяет им открываться при увеличении давления выше определённого предела.
Водород и кислород, которые выделяются на электродах при зарядке, взаимодействуют с выделением воды. А в случае превышения допустимого заряда они выпускаются в атмосферу. Этот механизм называют VRLA или Valve Regulated Lead Acid Battery. Устройство лабиринтной вентиляции в корпусе АКБ является более совершенным. В такой конструкции выделяющиеся газы конденсируются, и образующаяся вода возвращается обратно в банки аккумулятора.
Есть батареи, устройство которых предусматривает наличие пламегасителей. Эти приспособления обеспечивают отсекание пламени от внутреннего пространства аккумулятора при воспламенении газов. По своей конструкции пламегасители являются мембранами. Аккумулятор подключается к автомобилю с помощью выводов из свинца. Положительного и отрицательного. Они выполняются разной толщины и маркируются соответствующим образом, чтобы не допустить ошибку при подключении.

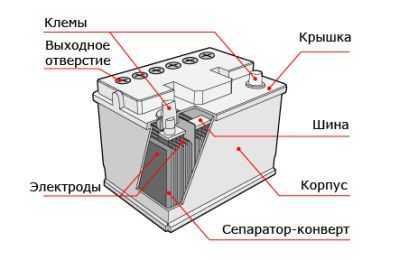
Выводы автомобильного аккумулятора
В зависимости от положения выводов полярность аккумуляторной батареи может быть прямая или обратная. Читайте подробнее о том, как определить полярность аккумулятора автомобиля.Устройство необслуживаемых батарей предусматривает наличие индикатором заряда. Его ещё называют гидрометром или просто «глазком». Подробнее об индикаторе заряда автомобильной АКБ читайте в статье по ссылке.
Крепление аккумулятора в подкапотном пространстве выполняется двумя основными способами:
- скобой за выступ корпуса АКБ. Такое крепление используется для аккумуляторов европейского типоразмера;
- при помощи рамки. Применяется в случае с батареями азиатского типоразмера.
Есть ещё АКБ американского типоразмера с боковым креплением клемм, но в нашей стране они практически не используются. Подробнее о типоразмерах и весе аккумуляторных батарей.
Вернуться к содержанию
Принцип работы аккумулятора в автомобиле
Теперь, когда вы знаете, как устроен автомобильный аккумулятор, поговорим о процессах в нём. Процессы, происходящие в свинцово-кислотном аккумуляторе, можно описать следующими реакциями:
Заряд описывается реакцией слева направо, а разряд ─ справа налево.
Анод (положительный электрод):
PbO2 + SO42- + 4H+ + 2e− -> PbSO4 + 2h4O
Катод (отрицательный электрод):
Pb + SO42- − 2e− ->PbSO4
При включении потребителей электрического тока начинается разряд АКБ. При этом диоксид свинца на положительных пластинах и губчатый свинец на отрицательных вступают в реакцию с серной кислотой. В результате выделяется сульфат свинца и вода. По мере разрядки батареи плотность электролита снижается.
Когда аккумулятор заряжается вода из электролита и сульфат свинца на пластинах преобразуются в PbO2, Pb, h4SO4. Плотность электролита растёт по мере зарядки и доходит примерно до 1,29 гр/см3 при полном заряде. Процесс растворения сульфата свинца проходит не до конца. Поэтому идёт постоянный процесс сульфатации пластин АКБ.

Зарядка аккумулятора автомобиля
Зарядка аккумуляторной батареи осуществляется как от генератора при поездке, так и от сетевого зарядного устройства. На работу батареи влияет температура окружающей среды. При повышенной температуре увеличивается токоотдача и мощность, но растёт саморазряд и расход воды. При пониженных температурах замедляются химические процессы, снижается пусковой ток и разрядная ёмкость. Электролит в разряженном аккумуляторе на сильном морозе может замёрзнуть.
Саморазряд аккумулятора зависит от типа батареи, температуры ОС, легирующих добавок в сплаве пластин. Срок службы большинства автомобильных аккумуляторов составляет 3─5 лет и сильно зависит от условий эксплуатации и регулярного обслуживания.
Если вы выбираете себе новую АКБ, то можете прочитать статью про аккумулятор Варта. Вернуться к содержанию
Основные характеристики автомобильного аккумулятора
В заключение стоит сказать об основных характеристиках аккумулятора для автомобиля. Среди них:
- ёмкость;
- напряжение;
- ток холодной прокрутки.
Значения всех этих параметров можно найти на этикетке АКБ или на сайте производителя. Номинальной ёмкостью батареи называется энергия полностью заряженной батареи, которую она отдаёт в процессе разряда 20 часов. Величина выражается в ампер-час. Распространённые АКБ для автомобиля 55 Ач обязаны в течение двадцати часов обеспечивает ток 2,75 ампера. Хотя на практике такой разряд не используется. От аккумулятора требуется отдавать сотни ампер в течение нескольких секунд, когда выполняется запуск двигателя.
Иногда можно встретить понятие резервной ёмкости. Это значение представлено в минутах. К примеру, аккумулятор должен проработать 90 минут при токе разряда 25 ампер и при этом напряжение не должно упасть ниже 10,5 вольта. По-простому говоря, это время, которое аккумуляторная батарея будет обеспечивать свои функции, и подменять генератор.
Что касается напряжения, то на легковых автомобилях устанавливаются АКБ с номиналом 12 вольт без вариантов.
Величина тока холодной прокрутки показывает значение, отдаваемое АКБ при температуре минус 18 градусов Цельсия в течение 10 секунд. Напряжение на аккумуляторе не должно упасть ниже 7,5 вольта. То есть, ток прокрутки показывает, насколько резво и долго батарея сможет крутить стартер в мороз. Надеемся, что статья была для вас полезной. Если да, то расскажите о нас в социальных сетях. Голосуйте в опросе ниже и оценивайте статью! Исправления и дополнения ждём в комментариях!
Вернуться к содержанию
Примите участие в опросе!
Загрузка ...Оцените статью!
(голосов: 3, в среднем: 4,67 из 5) Загрузка...akbinfo.ru
Механизм работы аккумулятора
Аккумуляторы — это химические источники тока с обратимым процессом: они могут отдавать энергию, преобразуя химическую энергию в электрическую, или накапливать энергию, преобразуя электрическую энергию в химическую. Таким образом, аккумулятор попеременно то разряжается, отдавая электрическую энергию, то заряжается от какого-либо соответствующего источника постоянного тока.
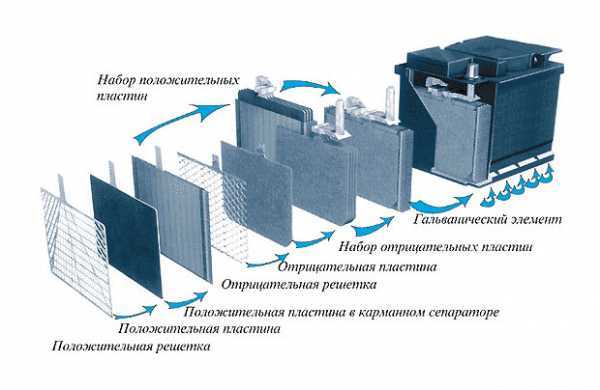
Схема сборки аккумулятора.
Аккумуляторы, в зависимости от применяемого в них электролита, подразделяются на кислотные и щелочные. Кроме того, аккумуляторы различаются, в зависимости от материала электродов. Широкое применение имеют лишь свинцовые, кадмиево-никелевые, железо-никелевые и серебряно-цинковые аккумуляторы.
Емкость аккумулятора определяется количеством электричества qp, которое он может отдать при разряде в питаемую цепь.
Это количество электричества измеряется не в кулонах, а в более крупных единицах — ампер-часах (а-ч). 1 а-ч = 3600 кл. Но для заряда аккумулятора требуется большее количество электричества q3, чем отдаваемое при разряде. Отношение qp : q3 =ne называется отдачей аккумулятора по емкости.
Напряжение, необходимое для заряда аккумулятора, значительно выше того напряжения на зажимах аккумулятора, при котором он отдает длительно разрядный ток.
Схема устройства аккумулятора.
Важной характеристикой аккумулятора являются его средние зарядное и разрядное напряжения.
Ясно, что из-за ряда потерь энергии аккумулятор отдает при разряде значительно меньшее количество энергии Wp, чем получает при заряде. Отношение Wp : W3= n есть коэффициент полезного действия или отдача по энергии аккумулятора.
Наконец, весьма важной для характеристики аккумулятора величиной является его удельная э н е р г и я, т. е. количество энергии, отдаваемой при разряде, приходящееся на 1 кг веса аккумулятора. Особенно существенно, чтобы удельная энергия была возможно больше у нестационарных аккумуляторов, устанавливаемых, например, на самолетах. В подобных случаях обычно она важнее, чем коэффициент полезного действия и отдача по емкости.
Следует иметь в виду, что при медленном разряде процесс в аккумуляторе протекает равномерно во всей массе пластин, благодаря чему при длительном разряде малым током емкость аккумулятора больше, чем при кратковременном разряде большим током. При быстром разряде процесс в массе пластин отстает от процесса на их поверхности, что вызывает внутренние токи и уменьшение отдачи.
Напряжение аккумулятора существенно изменяется во время разряда. Желательно, чтобы оно было возможно более постоянным. В расчетах обычно указывается среднее разрядное напряжение Up. Но для заряда аккумулятора нужен источник тока, дающий значительно большее зарядное напряжение Uз (на 25— 40%). В противном случае невозможно зарядить аккумулятор полностью.
Схема литиево-кислородного аккумулятора.
Если напряжение одного аккумуляторного элемента недостаточно для данной установки, то необходимое число аккумуляторных элементов соединяется последовательно. Конечно, последовательно соединять можно только аккумуляторы, рассчитанные на одну и ту же разрядную силу тока.
Если разрядный ток одного элемента недостаточен, то применяется параллельное соединение нескольких одинаковых элементов.
Из числа кислотных аккумуляторов практическое значение имеют лишь свинцовые аккумуляторы. В них на положительном электроде активным веществом служит двуокись свинца РЬ02, на отрицательном электроде — губчатый свинец РЬ. Положительные пластины имеют бурый цвет, отрицательные— серый, в качестве электролита применяется раствор серной кислоты h4S04 с с удельным весом 1,18—1,29.
Химический процесс разряда и заряда свинцового аккумулятора относительно сложен. В основном он сводится к восстановлению свинца на положительном электроде и окислению губчатого свинца на отрицательном электроде в закисную соль серной кислоты. При этом образуется вода и, следовательно, плотность электролита уменьшается. При разряде сначала напряжение аккумулятора быстро падает до 1,95 В, а затем медленно понижается до 1,8 В. После чего необходимо прекратить разряд.
При дальнейшем разряде имеет место необратимый процесс образования кристаллического сернокислого свинца PbS4. Последний покрывает пластины белым налетом. Он обладает большим удельным сопротивлением и почти не растворим в электролите. Слой сернокислого свинца увеличивает внутреннее сопротивление активной массы пластин. Такой процесс называется сульфатацией пластин.
При заряде аккумулятора процесс идет в обратном направлении: на отрицательном электроде восстанавливается металлический свинец, а на положительном электроде свинец окисляется до двуокиси РЬ02. Ион S04 переходит в электролит, поэтому плотность серной кислоты при заряде увеличивается, следовательно, возрастает и удельный вес электролита. Для измерения удельного веса электролита применяется специальный ареометр. По его показаниям можно ориентировочно судить, в какой мере аккумулятор заряжен. Среднее разрядное напряжение свинцового аккумулятора 1,98 В, а среднее зарядное напряжение 2,4 В.
Схема зарядки аккумулятора.
Внутреннее сопротивление rBн свинцовых аккумуляторов, благодаря малому расстоянию между пластинами и большой площади их соприкосновения с электролитом, весьма мало: порядка тысячных долей ома у стационарных аккумуляторов и сотых долей у небольших переносных аккумуляторов.
Вследствие малого внутреннего сопротивления и относительно большого напряжения КПД этих аккумуляторов достигает 70— 80 %, а отдача — 0,85—0,95 %.
Однако из-за малого внутреннего сопротивления в свинцовых аккумуляторах при коротких замыканиях возникают токи очень большой силы, что приводит к короблению и распаду пластин.
Свинцовые аккумуляторы обладают рядом существенных недостатков. Они тяжелы из-за большого веса свинца пластин, и их объем велик из-за значительного количества электролита, активно участвующего в процессе. В них неизбежен саморазряд внутренними паразитными электрическими токами с потерей заряда порядка 1 % в сутки. Наконец, они весьма чувствительны к толчкам и сотрясениям. Но их отдача и КПД значительно выше, чем у любых других аккумуляторов.
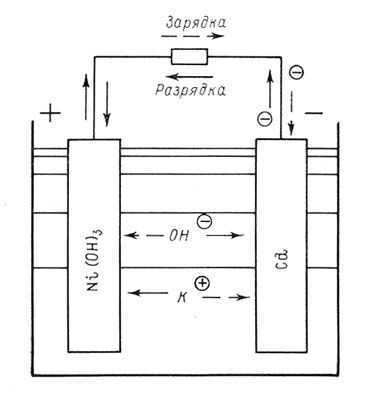
Из числа щелочных аккумуляторов широкое применение в настоящее время имеют кадмиево-никелевые, железо- никелевые и серебряно-цинковые. Во всех этих аккумуляторах электролитом служит щелочь — примерно двухпроцентный раствор едкого калия КОН или едкого натра NaOH. При заряде и разряде этот электролит почти не претерпевает изменений. Следовательно, от его количества емкость аккумулятора не зависит. Это дает возможность свести к минимуму количество электролита во всех щелочных аккумуляторах и таким путем существенно их облегчить.
Остовы положительной и отрицательной пластин этих аккумуляторов делаются из стальных никелированных рамок с пакетами для активной массы. Благодаря такой конструкции активная масса прочно удерживается в пластинах и не выпадает при толчках.
Схема устройства пластин свинцового аккумулятора.
В кадмиево-никелевом КН аккумуляторе активным веществом положительного электрода служат окислы никеля, смешанные для увеличения электропроводности с графитом; активным веществом отрицательного электрода является губчатый металлический кадмий Cd. При разряде на положительном электроде расходуется часть активного кислорода, содержащегося в окислах никеля, а на отрицательном электроде окисляется металлический кадмий. При заряде обратно обогащается кислородом положительный электрод: гидрат закиси никеля Ni(OH)2 переходит в гидрат окиси никеля Ni(OH)3. На отрицательном электроде гидрат закиси кадмия восстанавливается в чистый кадмий. Приближенно процесс в этом аккумуляторе может быть выражен химической формулой:
разряд
2Ni (ОН)3 + 2КОН + Cd ??2Ni (ОН)2 + 2КОН + Cd (ОН)2.
заряд
Как показывает формула, из электролита при разряде выделяется частица (ОН)2 на отрицательной пластине и такая же частица переходит в электролит на положительной пластине. При заряде процесс идет в обратном направлении, но в обоих случаях электролит не изменяется.
Устройство железо-никелевого аккумулятора отличается лишь тем, что в нем в отрицательных пластинах кадмий заменен мелким порошком железа (Fe). Химический процесс этого аккумулятора можно проследить по вышеприведенному для кадмиево-никелевого аккумулятора уравнению путем замены Cd на Fe.
Применение железа вместо кадмия удешевляет аккумулятор, делает его более прочным механически и увеличивает срок его службы. Но с другой стороны, у железо-никелевого аккумулятора при том же примерно разрядном напряжении зарядное напряжение на 0,2 В выше, вследствие чего КПД этого аккумулятора ниже, чем кадмиево-никелевого. Затем очень важным недостатком железо-никелевого аккумулятора является относительно быстрый саморазряд. У кадмиево-никелевого аккумулятора саморазряд мал, и поэтому ему отдается предпочтение в тех случаях, когда аккумулятор должен длительно находиться в заряженном состоянии, например для питания радиоустановок. Среднее разрядное напряжение обоих этих аккумуляторов равно 1,2 В.
Схема железоникелевого аккумулятора.
Герметически закрытые сосуды вышеописанных щелочных аккумуляторов выполняются из листовой никелированной стали. Болты, через которые пластины аккумуляторов соединяются с внешней целью, пропускаются через отверстия в крышке сосуда, причем болт, с которым соединены отрицательные пластины, тщательно изолирован от стального корпуса; но болт, соединенный с положительными пластинами, от корпуса не изолируется.
Внутреннее сопротивление щелочных аккумуляторов значительно больше, чем кислотных, благодаря этому они лучше переносят короткие замыкания. Но по той же причине КПД щелочных аккумуляторов (порядка 45%) значительно ниже, чем кислотных, также существенно меньше их удельная энергия и отдача по емкости (0,65). Так как состояние электролита у щелочных аккумуляторов при работе не изменяется, то определить их степень заряженности по внешним признакам нельзя. Вследствие чего за зарядом приходится следить на основании их емкости и напряжения. При заряде нужно сообщить аккумулятору количество электричества It=q значительно большее, чем его емкость, примерно в 1,5 раза. Например, аккумулятор емкостью 100 а-ч желательно заряжать током силой в 10 а в течение 15 час.
http://www.youtube.com/watch?v=DuZSNfTNDyg
Серебряно-цинковые аккумуляторы являются новейшими из числа современных аккумуляторов. Электролитом в них служит водный раствор едкого калия КОН с удельным весом 1,4, с активным веществом положительного электрода (окисью серебра Ag20) и отрицательного электрода (цинком Zn). Электроды изготавливаются в виде пористых пластин и отделяются друг от друга пленочной перегородкой.
При разряде аккумулятора окись серебра восстанавливается до металлического серебра, а металлический цинк окисляется до окиси цинка ZnO. Обратный процесс происходит при заряде аккумулятора. Основная химическая реакция выражается формулой
разряд
AgsO + КОН + Zn ?? 2Ag + КОН + ZnO.
заряд
http://www.youtube.com/watch?v=0jbnDTRtywE
Устойчивое разрядное напряжение составляет около 1,5 В. При небольших токах разряда это напряжение почти не изменяется в течение примерно 75— 80% времени работы аккумулятора. Затем оно довольно быстро падает, и при напряжении 1 в разряд следует прекращать.
Внутреннее сопротивление серебряно-цинковых аккумуляторов существенно меньше, чем остальных щелочных аккумуляторов. При равной емкости первые значительно легче. Они удовлетворительно работают как при пониженной (—50° С), так и при повышенной ( + 75° С) температурах. Наконец, они допускают большие разрядные токи. Например, некоторые типы таких аккумуляторов можно разогреть током короткого замыкания в течение одной минуты.
http://www.youtube.com/watch?v=bW_5q7saSR8
Выше изложены только основные сведения по аккумуляторам. При практической работе с аккумуляторами, в особенности со свинцовыми, необходимо тщательно выполнять соответствующие заводские инструкции. Нарушение их вызывает быстрое разрушение аккумуляторов.
Поделитесь полезной статьей:
fazaa.ru
Что из себя представляет аккумуляторная батарея
Базовый принцип работы свинцово-кислотного аккумулятора (АКБ), определяемый термином «двойная сульфатация», был разработан (изобретен) более полутора веков назад в районе 1860 года и с тех пор никаких принципиальных новшеств не претерпел. Появилось достаточное количество специализированных моделей, но устройство аккумулятора выпущенного вчера в Японии или производимого сегодня в России или в Германии, такое же, как и устройство самой первой батареи собранной «на коленке» во Франции, с неизбежными улучшениями и оптимизацией.
Назначение
АКБ в обычном автомобиле предназначен для работы стартера при запуске двигателя и для устойчивого снабжения заданного вольтажа электроэнергией, многочисленного электрооборудования. При этом роль автомобильного аккумулятора, как «энергетического буфера», при недостаточном поступлении энергии от генератора не менее важна. Типичный пример подобного режима – при работе двигателя на холостых оборотах во время стояния в пробке. В такие моменты весь электропакет и дополнительное сервис-оборудование запитаны только от аккумулятора. Критически важна роль кислотного аккумулятора при аварийных форс-мажорах: поломка генератора, регулятора напряжения, выпрямителя тока, при обрыве ремня генератора.
Правила подзарядки
Подзарядка свинцово-кислотного автомобильного аккумулятора в штатном режиме производится от генератора. При интенсивной работе батареи требуется ее дополнительная подзарядка в стационарных условиях через специальное зарядное устройство. Особенно это актуально в зимнее время, когда возможность холодной батареи принимать заряд резко снижается, а потребление энергии на раскрутку мотора на морозе возрастает. Поэтому зарядку автомобильного АКБ необходимо проводить в тепле после его согревания естественным образом.
Важно! Ускорение согревания батареи горячей водой или феном недопустимо, так как реально разрушение пластин вследствие резкого перепада температур. При опадении наполнителя на дно банок, резко возрастает возможность саморазряда за счет замыкания пластин. Для так называемых «кальциевых» аккумуляторов, недопущение полного или значительного разряда критически важно, потому что ресурс этого типа батарей ограничен 4-5 циклами полной разрядки, после чего аккумулятор приходит в негодность.
В современных гибридных автомобилях и в электромобилях аккумуляторная батарея имеет повышенные размеры и емкость, обеспечивая движение. Их так и называют – тяговые. В «чистых» электромобилях только аккумуляторы являются поставщиком энергии для движения и работы всего электрооборудования, отчего имеют значительные размеры и в разы большую емкость, чем батарея в «классическом» автомобиле с карбюраторным двигателем. Например: танковые, тепловозные, на подводных лодках и так далее. Хотя принцип кислотного аккумулятора во всех случаях одинаков за исключением размеров.
Устройство кислотного АКБ и принцип его работы
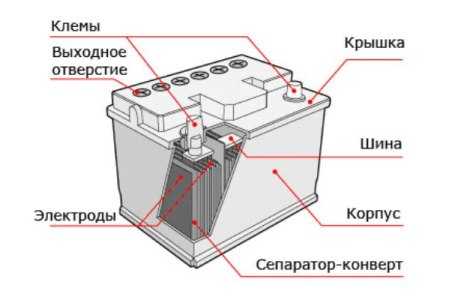
Устройство кислотной АКБ (свинцово-кислотного) различного назначения, от разных производителей отличается не принципиально и в тезисной форме выглядит следующим образом:
- пластиковый контейнер-корпус из инертного, устойчивого к агрессивной среде материала;
- в общем корпусе располагается несколько модулей-банок (как правило шесть), которые являются полноценными источниками тока и соединяются между собой тем или иным способом в зависимости от основных задач;
- в каждой банке располагаются плотные пакеты, состоящие последовательно из разделенных диэлектрическими сепараторами отрицательно и положительно заряженных пластин (свинцовый катод и анод из диоксида свинца соответственно). Каждая пара пластин является источником тока, их параллельное соединение кратно увеличивает выдаваемое на напряжение;
- пакеты залиты раствором химически чистой серной кислоты, разбавленной до определенной плотности дистиллированной водой.
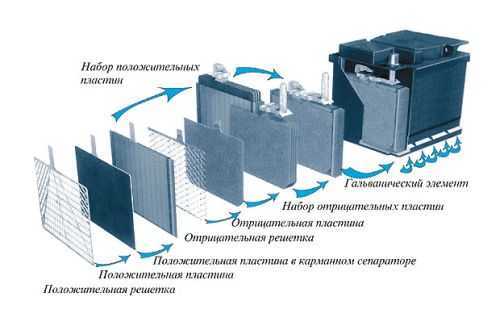
Работа кислотного аккумулятора
В процессе работы кислотного аккумулятора на катодных пластинах образуется сульфат свинца и выделяется энергия в виде электрического тока. За счет выделяемой в процессе электрохимической реакции воды плотность кислотного электролита падает, он становится менее концентрированным. При подаче напряжения на клеммы в процессе зарядки происходит обратный процесс с восстановлением свинца до металлической формы и повышается концентрация электролита.
Как устроена щелочная батарея и принцип ее работы
Устройство щелочной батареи аналогично таковому у кислотного. Но положительно и отрицательно заряженные пластины имеют другой элементный состав, а в качестве электролита используется раствор едкого кали определенной плотности. Есть и другие отличия — в самом корпусе контейнера, выводе клемм и в наличии мелкосетчатой «рубашки» вокруг каждой отдельной пластины.
Отрицательные катоды традиционного щелочного аккумулятора выполнены из губчатого кадмия с примесью губчатого железа, положительные – из гидроокиси трехвалентного никеля с добавлением чешуйчатого графита, добавка которого, обеспечивает лучшую электропроводность катода. Пары пластин параллельно соединяются между собой в банках, которые тоже соединены параллельно. В процессе зарядки щелочного аккумулятора двухвалентный никель в гидрате закиси меняет валентность до значения «8» и превращается в гидрат окиси; соединения кадмия и железа восстанавливаются до металлов. При разрядке процессы противоположны.

Достоинства щелочной АКБ
К достоинствам щелочного типа относятся:
- внутреннее устройство обеспечивает повышенную устойчивость к механическим нагрузкам, в том числе к тряске и ударам;
- разрядные токи могут быть значительно выше, чем у кислотного аналога;
- в принципе отсутствует испарение/выделение вредных веществ с газами;
- легче и меньше при равных емкостях;
- имеют очень высокий ресурс и служат в 7-8 раз дольше;
- для них не является критичными перезаряд или недозаряд;
- эксплуатация их проста.
По достижении максимального возможного заряда и при продолжении подключения к зарядному устройству никаких отрицательных электрохимических процессов с элементами не происходит. Просто начинается электролиз воды на водород и кислород с ростом концентрации едкого кали и падением уровня электролита, что безопасно и легко компенсируется добавлением дистиллированной воды. Очевидно, что имеются показатели, по которым этот тип аккумуляторов хуже кислотного:
- использование дорогостоящих материалов повышает стоимость на единицу емкости до четырех раз;
- более низкое – 1,25 В против 2 и выше В — напряжение на элементах.
Заключение
Правильная эксплуатация любого типа АКБ обеспечивает его долгую и надежную работу, что не только позволяет экономить финансы, но и гарантирует большую безопасность и комфорт при езде на автомобиле.
znanieavto.ru
Как работает аккумулятор
May 21, 2015
 Аккумулятор – устройство для электрохимического хранения энергии, состоящее из одного или более электрохимических элементов. Электрохимические реакции аккумулятора электрически обратимы. В зависимости от сферы применения, аккумуляторы бывают различной формы и размера: миниатюрные для электроники и до мегаваттных систем, подключаемых к системе стабилизации сети распределения электроэнергии.
Аккумулятор – устройство для электрохимического хранения энергии, состоящее из одного или более электрохимических элементов. Электрохимические реакции аккумулятора электрически обратимы. В зависимости от сферы применения, аккумуляторы бывают различной формы и размера: миниатюрные для электроники и до мегаваттных систем, подключаемых к системе стабилизации сети распределения электроэнергии.
Перезаряжаемая батарея состоит из отдельных батарей или ячеек соединенных между собой для обеспечения электропроводности. Аккумуляторные батареи часто оснащены датчиком температуры, который используется зарядным устройством для определения конца зарядки.
Все батареи, в том числе и аккумуляторные или перезаряжаемые, работают по одному принципу. Любая батарея это емкость с химическими веществами, которые вырабатывают электричество. Химические реакции в емкости основаны на электрохимии. В своем простейшем виде электрохимическая реакция в батарее это окисление металла электролитом (например, кислота).
При окислении металл электрода испускает электроны. Эти электроны передаются на второй электрод, находящийся в том же растворе электролита, в результате движения заряженных частиц и получается электричество. Оба электрода подключаются к различным полюсам напряжения и непосредственно не связаны друг с другом. Поток электронов происходит от отрицательно заряженного электрода к положительному.
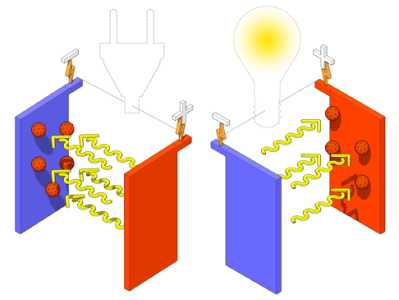 Аккумуляторные батареи работают по тому же принципу, что и обычные батареи питания, создавая поток заряженных частиц, электронов, между двумя электродами. В обычной батарее заряд может направляться только в одну сторону, с отрицательного электрода на положительный. Если заряд такой батареи иссякает, ее выбрасывают. В аккумуляторной батарее заряженные частицы от внешнего источника направляются от положительного электрода на отрицательный, по существу наполняя ее электроэнергией, что позволяет ее использовать снова.
Аккумуляторные батареи работают по тому же принципу, что и обычные батареи питания, создавая поток заряженных частиц, электронов, между двумя электродами. В обычной батарее заряд может направляться только в одну сторону, с отрицательного электрода на положительный. Если заряд такой батареи иссякает, ее выбрасывают. В аккумуляторной батарее заряженные частицы от внешнего источника направляются от положительного электрода на отрицательный, по существу наполняя ее электроэнергией, что позволяет ее использовать снова.
Первый и самый большой аккумулятор – свинцово-кислотная батарея была создана в 1859 году. В этом устройстве использовались свинец и окись свинца в качестве электродов и кислотный электролит в качестве среды. Эта конструкция была громоздкой и небезопасной для постоянного личного пользования, но стала основой, будущим аккумуляторам.
Изначально, в простых батарейках использовался жидкий электролит – йод или соляной раствор. Современные аккумуляторы изготавливаются с сухими или пастообразными электролитными соединениями. Один из старейших и самых известных типов аккумуляторных батарей являются свинцово-кислотные аккумуляторы, широко применяемые в автомобилях. На протяжении многих лет компоненты аккумуляторных батарей становились меньше и менее опасными, что позволило использовать их в различных устройствах, в особенности электронных устройствах небольшого размера, таких как мобильные телефоны или портативные компьютеры. Наиболее распространенный вид современных аккумуляторов это высокоэффективные литий-ионные батареи и их варианты, которые могут использоваться в течение нескольких лет, прежде чем их необходимо будет заменить.
Зарядка аккумулятора осуществляется путем подачи нового потока электронов в направлении обратном разрядке. Чтобы сделать это используется источник энергии и адаптер. Адаптер – устройство преобразующее ток источника. Необходимость адаптера объясняется тем, что ток, подаваемый к батарее, должен быть таким же какой вырабатывает батарея.
 Никель-кадмиевые и никель-металлогидридные аккумуляторы
Никель-кадмиевые и никель-металлогидридные аккумуляторы
Эти аккумуляторы стали продуктом развития свинцово-кислотных батарей. Они стали меньше и более безопасными. В этих аккумуляторах используется оксид никеля в качестве катода и металлический кадмий в качестве анода. В качестве электролита применяется гидроксид калия. При правильной эксплуатации эти батареи должны полностью израсходовать свой заряд, прежде чем приступать к их зарядке. Никель-кадмиевые аккумуляторы очень надежные, до сих пор используются в суровых условиях, где в работе других батарей может произойти сбой. Из основных недостатков можно выделить то, что кадмиевые компоненты достаточно опасны и дорогостоящие, а также зарядка только после полной разрядки, несоблюдение этого правила приводит к потере энергии.
Из-за проблем с кадмием были созданы более эффективные никель-металлгидридные (NiMH) батареи. В таких аккумуляторах в качестве анода используется водород. Эти батареи имеют множество применений, заменить свинцово-кислотные аккумуляторы в автомобилях или бытовое применение.
Литий-ионные аккумуляторы
Литий-ионные аккумуляторы являются самой последней формой аккумуляторных батарей. Благодаря своей долговечности, эффективности и компактности они стали оптимальным выбором для долгосрочного использования аккумуляторных батарей особенно в мобильных телефонах, компьютерах и других электронных устройствах. В качестве электродов в этих устройствах применяются литий и углерод. Литий может содержать большое количество энергии и терять лишь небольшую часть в течение долгого времени. Подзарядка такого аккумулятора может производиться в любое время.
https://youtu.be/oAIFNtOtQRs
"Питер - АТ"
ИНН 780703320484
ОГРНИП 313784720500453












