Всегда ли нужно охлаждать раствор до возможно более низкой температуры
Всегда ли нужно охлаждать раствор до возможно более низкой температуры
1 МИНИСТЕРСТВО ОБРАЗОВНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «САРАТОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ Н.Г. ЧЕРНЫШЕВСКОГО» Авторы составители: Кожина Л.Ф., Пожаров М.В. Лабораторный практикум «Синтез, очистка и идентификация химических веществ» Учебно-методическое пособие Саратов 2015
2 УДК 546 К58 Авторы составители: Кожина Л.Ф., Пожаров М.В. Лабораторный практикум «Синтез, очистка и идентификация химических веществ». Электронный ресурс. Саратов с. Данное пособие составлено в соответствии с учебной программой дисциплины, изучаемой студентами Института химии 1 курса, обучающихся по направлению подготовки «Прикладная химия», и ставит своей целью освоение студентами навыков и приемов лабораторного эксперимента. В пособии заложен исследовательский подход к обучению, который предусматривает подготовку студентов к самостоятельной творческой работе. Данный химический практикум является вторым в процессе изучения химии, выполняется во 2 семестре одновременно с практикумом по химии элементов. Лабораторные работы, выполняемые по данной дисциплине, основаны на применение знаний, полученных студентами при изучении теоретических основ общей химии в 1 семестре и химии элементов, изучаемой во 2 семестре. Кроме методик, описывающих технику выполнения эксперимента, в каждой работе имеются вопросы на взаимосвязь с ранее изученным материалом и его практическому применению к рассматриваемому методу синтеза, очистки и/или идентификации получаемого соединения. Содержание практикума учитывает условия, важные для начинающих исследователей: небольшой подготовительный период; доступность необходимых сведений в справочной и учебной литературе; минимальное количество трудоемких операций; перспективы быстрого (во времени) получения результатов, возможность их теоретического обоснования. Исследовательский подход требует гораздо больше времени на выполнение студентами заданий, чем частично поисковый и репродуктивный. Рекомендует кафедра общей и неорганической химии Института химии СГУ НМС Института химии СГУ Рецензент доцент кафедры общей и неорганической химии к.х.н. Акмаева Т.А.
3 Содержание практикума составлено в соответствии с учебной программой дисциплины «Методы синтеза, очистки и идентификации неорганических веществ» и ставит своей целью освоение студентами навыков и приемов лабораторного эксперимента на основе систематического изучения теоретической химии и основных свойств химических элементов и их соединений. Лабораторным работам предшествует лекционное и дискуссионное обсуждение изучаемого материала. Такое объединение теоретических и лабораторных занятий способствует более глубокому усвоению изучаемого материала. В данном пособии заложен исследовательский подход к обучению, который предусматривает подготовку студентов к самостоятельной творческой работе. Использование этого подхода на первом курсе делает необходимой дифференциацию студентов по их возможности на определенном уровне осваивать навыки выполнения исследовательских работ. Такая дифференциация требует и соответствующего подхода к умениям, вырабатываемым в ходе практикума: выделение обязательного минимума экспериментальных опытов и максимального объема работ, рекомендуемых для наиболее успевающих студентов. При этом каждый студент должен быть ознакомлен с полным содержанием практикума, что послужит стимулом для его творческого роста. Пособие содержит практический материал по лабораторным способам получения различных неорганических соединений. Кроме методик, описывающих технику выполнения эксперимента, в каждой работе имеются вопросы на взаимосвязь с ранее изученным материалом и его практическому применению к рассматриваемому методу синтеза, очистки и/или идентификации получаемого соединения. Вначале студенты изучают цель и методику выполнения каждой лабораторной работы, затем проводят химический эксперимент, в ходе которого получают данные, на основании которых проводят идентификацию и исследование физико-химических свойств рассматриваемого в работе соединения; записывают уравнения химических реакций, свои наблюдения; при помощи ответов на предлагаемые вопросы делают выводы о проведенном исследовании. Содержание практикума учитывает условия, важные для начинающих исследователей: небольшой подготовительный период; доступность необходимых сведений в справочной и учебной литературе; минимальное количество трудоемких операций; перспективы быстрого (во времени) получения результатов, возможность их теоретического обоснования. Исследовательский подход требует гораздо больше времени на выполнение студентами заданий, чем частично поисковый и репродуктивный. В связи с этим возникла необходимость в подготовке данного учебно-методического пособия, которое позволит выявить и систематизировать элементы исследовательского характера, повысить познавательную активность студентов с учетом их склонности к выполнению определенного вида деятельности.
4 Предложенный алгоритм проведения и оформления лабораторных работ способствует повышению качества знаний студентов, развитию логического мышления, умения анализировать, сравнивать и обобщать полученные результаты. Основная задача выполнения лабораторных работ помощь студентам в усвоении законов и теоретических положений химии, уяснении влияния различных условий на протекание химических процессов, изучении свойств химических соединений. Лабораторные работы приносят пользу только в том случае, если они выполняются сознательно, а не механически по прописи. Выполняя конкретное задание, студент должен получить целостное представление о получаемом соединении и познакомиться с различными методами синтеза, очистки и идентификации. Большинство предлагаемых работ можно усложнить, вводя дополнительные вопросы. Это способствует проявлению студентами самостоятельности, инициативы и творческой активности, что способствует активному и сознательному усвоению материала. Данный химический практикум является вторым в процессе изучения химии, выполняется во 2 семестре одновременно с практикумом по химии элементов. Лабораторные работы, выполняемые по данной дисциплине, основаны на применение знаний, полученных студентами при изучении теоретических основ общей химии в 1 семестре и химии элементов, изучаемой во 2 семестре. В приложении представлены справочные материалы по свойствам основных неорганических веществ. Этот материал может быть использован студентами при объяснении многих закономерностей неорганической химии и при выполнении синтезов различных веществ, разделения смесей и очистке индивидуальных веществ. Порядок подготовки и правила выполнения лабораторной работы Лабораторные работы по изучаемой дисциплине способствуют приобретению студентами базовых навыков работы в лаборатории. Сознательное выполнение лабораторных работ возможно только при условии предварительной домашней подготовки: они обязаны самостоятельно проработать соответствующий теоретический материал и ознакомиться с содержанием предстоящей лабораторной работы. Если отчет о работе написан правильно, преподаватель расписывается в тетради студента, и работа будет считаться выполненной. Если преподаватель обнаружит ошибки в отчете, или будет неудовлетворен ответами на контрольные вопросы, студенту придется «сдавать» работу на следующем занятии или в дополнительное время. Разрешается выполнять отдельные опыты лабораторной работы небольшой группой (2-3 человека), распределив обязанности между собой. Это позволит студентам успеть выполнить сложные эксперименты в отведенное время. Работая небольшой группой, студенты могут обсуждать ход выполнения работы и результаты. Благодаря этому студенты приобретают навыки научного общения. Отчет должен быть составлен индивидуально.
5 До начала лабораторной работы студенты должны пройти инструктаж по технике безопасности. Кроме этого, перед выполнением каждой лабораторной работы преподаватель указывает на необходимые меры предосторожности. За каждым студентом в лаборатории закрепляется определенное рабочее место. Студент обязан следить за порядком на своем рабочем месте и поддерживать его чистоту. После окончания работы дежурные студенты приводят лабораторию в порядок. Для успешной сдачи отчета студент должен продемонстрировать свободное владение материалом практикума: знать способы получения и свойства изучаемых соединений; уметь изложить технику выполнения эксперимента; объяснять наблюдаемые превращения; показать приобретенные навыки и умения при составлении различных химических реакций и проведении расчетов (если работа носит количественный характер). Общие правила техники безопасности: 1. К любой работе следует приступать только тогда, когда все ее этапы известны и не вызывают сомнения. 2. Использовать для опытов минимальное количество реактивов; во избежания загрязнения реактивов склянки всегда должны быть закрыты пробками; не допускать использования пробок от других склянок. 3. Запрещается выносить за пределы лаборатории реактивы, а также передавать их кому-либо. 4. Все работы с летучими, токсичными и высокоагрессивными веществами проводить только в вытяжном шкафу при работающей вентиляции. 5. Не выливать в раковину остатки кислот, щелочей и других агрессивных веществ; их нужно сливать в специально предназначенные для этого склянки, находящиеся в вытяжном шкафу. 6. Не выбрасывать в раковину непрореагировавшие остатки металлов. 7. Не подносить к глазам и не приближать лицо к пробирке с кипящей жидкостью. Направлять пробирку с кипящей жидкостью так, чтобы предотвратить попадание ее на себя и окружающих. 8. Не отвлекать внимание студентов, проводящих эксперимент. 9. Все работающие в лаборатории должны уметь оказывать первую помощь при ожогах и отравлениях: при попадании на кожу кислоты или щелочи необходимо промыть обожженное место большим количеством воды, затем при ожогах кислотой 3%-ным раствором соды, а при ожогах щелочами 1%-ным раствором борной кислоты; при термическом ожоге кожу следует обмыть спиртом, а затем смазать мазью от ожогов.
6 Работа 1. Перекристаллизация веществ Цель: изучение процесса перекристаллизации как способа очистки веществ Выберите одну из предложенных ниже методик перекристаллизации. Рассчитайте количества соли и воды, необходимые для получения г насыщенного при 60 о С раствора. Налейте в стакан отмеренное цилиндром рассчитанное количество дистиллированной воды. Поместите в воду навеску предварительно растертой в ступке соли и нагрейте содержимое стакана почти до кипения при перемешивании стеклянной палочкой. Полученный горячий раствор профильтруйте через складчатый фильтр. Предлагаются следующие методики перекристаллизации. Перекристаллизация без удаления растворителя 1. Для солей, растворимость которых сильно зависит от температуры, раствор после горячего фильтрования охладите сначала на воздухе, а затем в бане со льдом (или водой) почти до 0 о С при непрерывном перемешивании. Температуру, до которой был охлажден раствор для кристаллизации, запишите в рабочий журнал. 2. Для очистки солей, растворимость которых мало зависит от температуры, можно использовать метод высаливания. Для этого раствор соли после горячего фильтрования охладите до комнатной температуры и добавьте равный по объему раствор концентрированной соляной кислоты (в вытяжном шкафу!) Перекристаллизация с удалением растворителя (упариванием раствора) Для солей, растворимость которых мало зависит от температуры, раствор перенесите во взвешенную фарфоровую чашку и упарьте на водяной бане приблизительно до половины начального объема. Затем раствор охладите до комнатной температуры (запишите ее в рабочем журнале), чашку с раствором протрите снаружи от воды, взвесьте и найдите потерю массы растворителя. Выпавшие кристаллы отфильтруйте на воронке Бюхнера с бумажным фильтром и промойте минимальным количеством охлажденной дистиллированной воды. Фильтрат сохраните. Предлагаемые для очистки вещества содержат нерастворимые примеси и примеси растворимых в воде хлоридов и/или сульфатов.
7 Опыт 1. Перекристаллизация дихромата калия, тиосульфата натрия, буры (кристаллогидрат тетрабората натрия) и/или кристаллической соды (кристаллогидрат карбоната натрия) Оборудование весы, газовая горелка с треножником, ступка, мерный цилиндр Посуда стаканы, колбы, воронки, фильтры бумажные, стеклянные палочки для перемешивания раствора Реактивы дихромат калия, тиосульфат натрия, бура и кристаллическая сода, нитрат серебра, хлорид бария Перед началом работы постройте график зависимости растворимости очищаемой соли от температуры с использованием таблично-справочных данных. На основании справочных данных о зависимости растворимости этих веществ от температуры обоснуйте выбор схемы для их очистки: — приготовление насыщенного при повышенной температуре раствора — быстрое фильтрование раствора, его охлаждение — отделение образовавшихся кристаллов от маточного раствора — промывание сушка. Для проведения перекристаллизации по этой схеме определите массу воды, требуемой для приготовления насыщенного при 60 о С раствора, исходя из заданной массы очищаемой соли. Проведите фильтрование горячего раствора, не допуская его охлаждения и выделения кристаллов на фильтре. Если они тем не менее образуются, переведите их в раствор, действуя небольшими порциями горячей воды. Позже эту воду следует испарить, иначе снижается выход чистого вещества. После отделения механических примесей охладите горячий раствор до 0 о С, проведите фильтрование при пониженном давлении (водяной насос, воронка Бюхнера); промойте вещество малыми порциями ледяной воды. Количественно перенесите очищенное кристаллическое вещество в чашку Петри или фарфоровую чашку и сушите: дихромат калия (нитрат калия) при о С; хлорид аммония и буру при комнатной температуре; тиосульфат и соду отжав между листами фильтровальной бумаги. Высушенное вещество соберите в сухую, заранее взвешенную пробирку с пробкой (бюкс) и взвесьте. Вычислите выход продукта в процентах от теоретически возможного. Очищенное вещество проверьте на наличие предполагаемых примесей, проведя соответствующие качественные реакции: растворите в небольшом объеме дистиллированной воды (1-2 мл) несколько кристаллов полученного вещества и добавьте 1-2 капли раствора нитрата серебра для определения
8 примеси хлоридов, или раствора хлорида бария для определения примеси сульфатов. При определении примесей сульфатов в дихромате калия в исследуемый раствор добавьте концентрированной соляной кислоты. Аналогично проанализируйте фильтрат на присутствие в нем примесей хлоридов и сульфатов. Если кристаллы содержат примеси, проведите повторную перекристаллизацию. Для этого взвесьте полученное вещество, рассчитайте количество воды, необходимое для приготовления насыщенного при 60 о С раствора, проведите все операции, как и в первый раз, кроме горячего фильтрования. Опыт 2. Перекристаллизация хлорида натрия, борной кислоты, нитрата натрия, кристаллогидрата сульфата меди (медного купороса) Оборудование весы, газовая горелка с треножником, ступка, мерный цилиндр, водяной насос, воронка Бюхнера Посуда стаканы, колбы, воронки, фильтры бумажные, стеклянные палочки для перемешивания раствора, чашка Петри Реактивы хлорид натрия, борная кислота, нитрат натрия, кристаллогидрат сульфата меди (медный купорос), концентрированная азотная кислота, гидроксид натрия, нитрат серебра, хлорид бария Предлагаемые для очистки вещества содержат нерастворимые примеси и примеси растворимых в воде хлоридов и/или сульфатов. Перед началом работы постройте график зависимости растворимости очищаемой соли от температуры с использованием таблично-справочных данных. Учитывая справочные данные о характере зависимости растворимости данных веществ от температуры, обоснуйте использование для их очистки следующей схемы: — приготовление насыщенного при повышенной температуре раствора загрязненного вещества — фильтрование раствора — упаривание и охлаждение — отделение образовавшихся кристаллов от маточного раствора — промывание сушка. Для проведения перекристаллизации по данной схеме вычислите массу воды, требуемую для приготовления насыщенного при 60 о С раствора, исходя из массы загрязненной соли, подлежащей очистке. Проведите фильтрование
9 этого раствора, не допуская охлаждения. Перенесите фильтрат в фарфоровую чашку и упарьте на водяной бане до появления пленки на поверхности раствора. В раствор борной кислоты после фильтрования добавьте несколько капель концентрированной азотной кислоты; в раствор нитрата натрия до фильтрования добавьте в соотношении 1:50 (по весу) гидроксид натрия для осаждения примесей солей железа. Фильтрат охладите до 0 о С, выдерживая его на льду. Образовавшиеся кристаллы отделите на воронке Бюхнера, промойте малыми порциями охлажденной воды, количественно перенесите очищенное вещество на чашку Петри и сушите: хлорид натрия и нитрат натрия при о С медный купорос и борную кислоту между листами фильтровальной бумаги. Высушенный препарат перенесите в сухую, предварительно взвешенную пробирку с пробкой, и взвесьте. Вычислите выход продукта от теоретически возможного. Проверьте полученное вещество на наличие возможных примесей (см. Опыт 1). Опыт 3. Перекристаллизация хлорида натрия (без стадии упаривания раствора) Оборудование весы, газовая горелка с треножником, ступка, мерный цилиндр, водяной насос, воронка Бюхнера, склянки Дрекселя Посуда стаканы, колбы, воронки, фильтры бумажные, стеклянные палочки для перемешивания раствора, чашка Петри, колба Вюрца с делительной воронкой Реактивы хлорид натрия, концентрированная серная кислота, нитрат серебра, хлорид бария Очистку хлорида натрия можно провести через стадию «высаливания» при пропускании в насыщенный раствор сухого хлороводорода. Приготовьте насыщенный при 60 о С раствор подлежащего очистке хлорида натрия, как описано в предыдущей работе, профильтруйте его, затем не упаривая, охладите до 0 о С и пропустите в охлаждаемый раствор высушенный хлороводород. Хлороводород получают при взаимодействии твердого хлорида натрия и концентрированной серной кислоты, при необходимости нагревая смесь (колба Вюрца с делительной воронкой). Для сушки хлороводород пропустите через склянку (или две) Дрекселя, заполненные концентрированной серной кислотой. Хлороводород пропускайте через
10 раствор хлорида натрия до тех пор, пока не перестанут выпадать кристаллы. Полноту их осаждения можно проверить, отобрав с помощью пипетки раствор над осадком и пропустив в него хлороводород. Если не наблюдается образования кристаллов, то можно считать, что полнота осаждения достигнута. Выделившиеся кристаллы отделите на воронке Бюхнера и далее работу проводите по плану, описанному в предыдущем опыте. Опыт 4. Перекристаллизация гидрокарбоната натрия Оборудование: весы, газовая горелка с треножником, мерный цилиндр, водяной насос, воронка Бюхнера Посуда стаканы, колбы, воронки, фильтры бумажные, стеклянные палочки для перемешивания раствора, чашка Петри, бюксы Реактивы хлорид натрия, гидрокарбонат натрия, этиловый спирт, нитрат серебра, хлорид бария Гидрокарбонаты щелочных металлов в водном растворе при нагревании могут разлагаться. Поэтому перекристаллизацию их из водных растворов следует проводить при комнатной температуре. Учитывая растворимость вещества при комнатной температуре (справочник), вычислите необходимую для приготовления насыщенного раствора массу воды исходя из заданной массы загрязненного вещества. Приготовьте насыщенный раствор, охладите до 0 о С и для выделения кристаллов прибавьте к нему безводный этиловый спирт. Выделившиеся кристаллы отделите на воронке Бюхнера, промойте малыми порциями охлажденной воды. Осадок высушите в эксикаторе или между листами фильтровальной бумаги. Затем перенесите в сухую, заранее взвешенную пробирку с пробкой (или бюкс) и взвесьте. Очищенное вещество проверьте на наличие возможных примесей (см. Опыт 1). При оформлении лабораторной работы необходимо ответить на следующие вопросы: — Почему раствор нагревают почти до кипения, хотя готовят насыщенным при температуре 60 о С? — От каких примесей происходит очистка при горячем фильтровании? -Почему при перекристаллизации происходит очистка от растворимых примесей? — Какие соли нельзя разделить методом перекристаллизации? — Каких потерь нельзя избежать в процессе перекристаллизации?
11 -Почему при охлаждении раствора необходимо перемешивание? Как размер кристаллов влияет на чистоту препарата? -Всегда ли нужно охлаждать раствор до возможно более низкой температуры? Почему? -Зачем упаривают раствор в случае солей с малой зависимостью растворимости от температуры? -Зачем добавляют кислоту при определении чистоты дихромата калия? -Почему выпадают кристаллы при высаливании? -Какие меры по технике безопасности необходимо соблюдать при выполнении работы? При ответе на указанные вопросы студенты должны учитывать материал, изученный в 1 семестре по теме «Растворы и их свойства». Работа 2. Разделение смесей веществ Опыт 1. Возгонка йода (демонстрация на лекции) Цель: изучение процесса сублимации как способа очистки веществ от примесей. Оборудование весы, газовая горелка с треножником и асбестовой сеткой Посуда круглодонная колба, стакан, колбы, стеклянные палочки, бюксы Реактивы йод кристаллический с примесями, оксид кальция Взвесьте 0,1 0,8 г кристаллического йода и прибавьте к нему 0,1 г йодида калия для удаления возможных примесей хлора и брома; и 0,2 г оксида кальция СаО. Смесь измельчите в фарфоровой ступке и поместите в прибор для возгонки: на дно химического стакана поместите очищаемую смесь, сверху поставьте круглодонную колбу с холодной водой и льдом, на поверхности которой будет конденсироваться йод. Полученный прибор разместите на треножнике с асбестовой сеткой и подведите газовую горелку для подвода тепла. Осторожно нагревайте и проведите возгонку. Низкая температура охлаждающего устройства способствует образованию мелких кристаллов. Сублимированное вещество осторожно снимите с поверхности охлажденной колбы с помощью стеклянной палочки (не использовать металлический шпатель), поместите в заранее взвешенный сухой бюкс, взвесьте и вычислите выход вещества в процентах %.
12 При оформлении лабораторной работы необходимо ответить на следующие вопросы: — На каком явлении основана очистка вещества методом возгонки? — Какие вещества способны к сублимации? -Объясните, почему при выборе приборов для возгонки предпочтение отдают конструкциям, в которых расстояние между возгоняемым веществом и поверхностью конденсации минимально. -Объясните, зачем добавляют йодид калия при очистке йода? -Существуют ли отличия в процессах сублимации йода и хлорида аммония? Если да, то какие? -Рассчитайте тепловой эффект фазового перехода йода из кристаллического состояния в парообразное. -Каковы особенности процесса сублимации по сравнению с другими методами очистки веществ (разделения смесей)? -Какие правила по технике безопасности необходимо соблюдать при выполнении данного опыта? При ответе на указанные вопросы студенты должны использовать знания, полученные при изучении вопросов термодинамики и химической связи. Опыт 2. Разделение смеси безводного сульфата натрия Na 2 SO 4 и хлорида аммония NH 4 Cl Цель: изучение способа разделения смеси, используя различие в свойствах компонентов смеси. Оборудование весы, газовая горелка с треножником и асбестовой сеткой Посуда круглодонная колба, стакан, стеклянные палочки, бюксы Реактивы сульфат натрия, хлорид аммония, хлорид бария, нитрат серебра Разделение смеси указанных веществ основано на способности хлорида аммония возгоняться. Необходимое для очистки количество смеси измельчите и поместите в прибор для возгонки. Сублимированное вещество осторожно снимите и поместите в сухой, заранее взвешенный бюкс. Оставшийся после возгонки продукт проверьте на ионы аммония и хлоридионы с помощью качественных реакций. Полученный продукт взвесьте, проверьте на наличие сульфат-ионов. Рассчитайте выход вещества от
13 теоретически возможного (массу хлорида аммония в смеси и массу смеси возьмите у преподавателя). Какие правила по технике безопасности необходимо соблюдать при выполнении данного опыта? При выполнении данного опыта используйте различия в термической устойчивости компонентов смеси. Опыт 3. Разделение смеси нитрата калия KNO 3 и ортофосфата кальция Ca 3 (PO 4 ) 2 Цель: изучение способа разделения смеси, используя различие в растворимости компонентов смеси Оборудование Посуда Реактивы весы, газовая горелка с треножником и асбестовой сеткой фарфоровая чашка, колба, стакан, стеклянные палочки, воронка для фильтрования, бюксы, воронка Бюхнера нитрат калия, ортофосфат кальция, нитрат серебра Способ разделения смеси основан на различной растворимости веществ: нитрат хорошо растворим, а ортофосфат плохо. Смесь поместите в стакан, внесите в 10 раз большую массу воды, в течение 10 минут хорошо перемешивайте, а затем отфильтруйте на плотном бумажном фильтре. В конце фильтрования небольшим количеством воды ополосните стакан, в котором была смесь. Промойте осадок на фильтре теплой водой, отделите от фильтра, поместите на часовое стекло, высушите и взвесьте. Фильтрат вместе с промывной водой поместите в фарфоровую чашку, упарьте на водяной бане до появления на поверхности пленки кристаллов. Охладите, отделите от маточного раствора на воронке Бюхнера, высушите и взвесьте. Полученные вещества проверьте на присутствие примесей: фосфатионов, ионов кальция, и нитрат-ионов. Вычислите состав исходной смеси в массовых долях. Сравните с заданным составом смеси (исходные данные о составе смеси получите у преподавателя). — Какие правила по технике безопасности необходимо соблюдать при выполнении данного опыта? При выполнении данного опыта используйте знания, полученные при изучении темы «Растворы».
14 Работа 3. Получение комплексных соединений Цель: приобретение навыков синтеза комплексных соединений и изучение их свойств Опыт 1. Получение гексагидроксокупрата (П) стронция Оборудование Весы, газовая горелка, треножник, асбестовая сетка Посуда коническая колба, воронка Бюхнера, водяной насос, часовое стекло, чашка Петри Реактивы бромид меди (II) CuBr 2, концентрированный (50%) водный раствор гидроксида натрия NaOH, нитрат стронция Sr(NO 3 ) 2, универсальный индикатор Внесите в коническую колбу емкостью 500 мл 2,50 г бромида меди (II) CuBr 2 и растворите при комнатной температуре в 25 мл воды. Затем добавьте к этому раствору 100 мл концентрированного (50%) водного раствора гидроксида натрия NaOH, заранее охлажденного до 5 о С. Полученный раствор, содержащий гексагидроксокупрат (II) натрия Na 4 [Cu(OH) 6 ] нагрейте до кипения и осторожно при тщательном перемешивании добавьте раствор, содержащий 7,0 г нитрата стронция Sr(NO 3 ) 2 и 20 мл воды. В результате взаимодействия образуется осадок. Быстро отделите его от раствора путем вакуумного фильтрования через фильтр со стеклянной, пористой пластинкой, промойте на фильтре небольшим количеством охлажденного ацетона и высушите на воздухе на часовом стекле или в чашке Петри. Идентификация тв.продукт, сине-фиолетовые кристаллы. Водный раствор этого вещества при добавлении универсального индикатора показывает наличие щелочной среды. Kачественная реакция на катион стронция: к раствору комплекса добавить хромат-ионы. Признак реакции — образование осадка, который растворяется в разбавленной уксусной кислоте. Опыт 2. Синтез [Cu(NH 3 ) 4 ]SO 4. H 2 O Оборудование весы Посуда стакан, воронка Бюхнера, водяной насос, часовое стекло, чашка Петри Реактивы сульфат пентагидрата меди(ii) CuSO. 4 5H 2 O, этанол, концентрированный раствор аммиака
15 Внесите в химический стакан емкостью 200 мл 5,0 г сульфата пентагидрата меди (II) CuSO 4 5H 2 O и растворите при умеренном нагревании в небольшом объеме воды (5-6 мл). Раствор слегка охладите и постепенно, при тщательном перемешивании прилейте к нему концентрированный раствор аммиака (NH 3. H 2 O) до полного растворения вначале голубого осадка сульфата гидроксомеди (II) (CuOH) 2 SO 4. К полученному темно-синему раствору сульфата тетраамминмеди (II) добавьте 5 мл этанола. Стакан со смесью охладите в бане со льдом. Отделите выпавшие кристаллы от раствора вакуумным фильтрованием и промойте их на фильтре смесью этанола с раствором аммиака (1:1 по объему). Высушите полученное вещество при температуре о С. Рассчитайте выход комплексной соли. Идентификация продукт ярко синие кристаллы; разлагаются при о С с образованием бесцветного безводного сульфата меди(ii) и газообразных аммиака и воды. Опыт 3. Получение хлорида гексаамминникеля (II) [Ni(NH 3 ) 6 ]Cl 2 Оборудование весы Посуда: стакан, воронка Бюхнера, водяной насос, часовое стекло, чашка Петри Реактивы: хлорид гексагидрата никеля(ii) NiCl. 2 6H 2 O, концентрированный водный раствор аммиака, кристаллический хлорид аммония NH 4 Cl, этиловый спирт Внесите в химический стакан емкостью 100 мл 5,0 г гексагидрата хлорида никеля(ii) NiCl. 2 6H 2 O и растворите при комнатной температуре в небольшом объеме воды (5-6 мл). Прилейте к раствору 25 мл концентрированного водного раствора аммиака (NH. 3 H 2 O), а затем добавьте 6,5 г кристаллического хлорида аммония NH 4 Cl. Тщательно перемешайте смесь до полного растворения соли. Полученный раствор охладите в водяной бане со лъдом. Выпавшие кристаллы отделите от раствора вакуумным фильтрованием и промойте их на фильтре небольшим объемом концентрированного водного раствора аммиака, затем 2-3 раза этиловым спиртом. Высушите при комнатной температуре. Рассчитайте выход комплексной соли. Идентификация голубовато-фиолетовые кристаллы, при нагревании до 450 о С разлагаются с образованием твердого хлорида никеля(ii) и газообразного аммиака.
16 Опыт 4. Синтез дигидрата трийодоплюмбата (II) калия K[PbI 3 ] 2H 2 O Оборудование Посуда Реактивы весы стаканы, воронка Бюхнера, водяной насос, часовое стекло, чашка Петри, водяная баня нитрат свинца(ii), йодид калия Внесите в термостойкий стакан емкостью 100 мл 4,0 г нитрата свинца(ii) Pb(NO 3 ) 2 и растворите при умеренном нагревании в 15 мл воды. В другом стакане также при умеренном нагревании растворите 15,0 г йодида калия KI в 15 мл воды. Затем, не охлаждая растворы, при тщательном перемешивании прилейте к раствору нитрата свинца(ii) раствор йодида калия. Образующийся желтый осадок йодида свинца(ii) PbI 2 по мере охлаждения смеси реагирует с избытком йодида калия с образованием светло-желтого дигидрата трийодоплюмбата(ii) калия. После охлаждения на холодной водяной бане полученный продукт отделите от жидкой фазы вакуумным фильтрованием (без промывки!) и высушите на воздухе. Идентификация светло-желтые кристаллы, реагирует с водой, концентрированными кислотами и щелочами. Рассчитайте выход комплексной соли. Опыт 5. Получение тригидрата триоксалатохромата (III) калия K 3 [Cr(C 2 O 4 ) 3 ] 3H 2 O Оборудование Посуда Реактивы весы, газовая горелка, треножник с асбестовой сеткой, водяная баня термостойкие стаканы, фарфоровая чашка, воронка Бюхнера, водоструйный насос, чашка Петри, бюксы дигидрат щавелевой кислоты, оксалат калия Внесите в термостойкий стакан емкостью 250 мл 9,0 г дигидрата щавелевой кислоты H 2 C 2 O. 4 2H 2 O и 4,0 г оксалата калия K 2 C 2 O 4. Растворите вещества при нагревании и перемешивании в 140 мл воды. В другом химическом стакане емкостью 100 мл приготовьте при умеренном нагревании раствор, содержащий 4,0 г дихромата калия K 2 Cr 2 O 7 и 42 мл воды. К раствору щавелевой кислоты и оксалата калия медленно, при интенсивном перемешивании по каплям прибавьте раствор дихромата калия. Полученную смесь вылейте в фарфоровую чашку и выпаривайте при
17 умеренном нагревании до появления на поверхности жидкости кристаллов. После этого охладите смесь в бане со льдом. Выпавшие при охлаждении кристаллы отделите от раствора вакуумным фильтрованием и высушите на воздухе. Рассчитайте выход комплексной соли. Идентификация темно-зеленые почти черные кристаллы, растворимые в воде. Опыт 6. Синтез тетрагидрата гекса(тиоцианато)хромата (III) калия K 3 [Cr(NCS) 6 ] 4H 2 O Оборудование весы, газовая горелка, треножник с асбестовой сеткой Посуда термостойкие стаканы, фарфоровая чашка, воронка Бюхнера, водоструйный насос, чашка Петри, бюкс Реактивы этанол, сульфат додекагидрата хрома(iii) калия KCr(SO 4 ). 2 12H 2 O, тиоцианат калия KSCN Внесите в термостойкий стакан емкостью 100 мл 5,0 г сульфат додекагидрата хрома(iii) калия KCr(SO 4 ). 2 12H 2 O и 6,0 г тиоцианата калия KSCN, растворите эти вещества в небольшом количестве воды 5-6 мл при умеренном нагревании. Затем перенесите полученный раствор в фарфоровую чашку и упарьте при умеренном нагревании до появления кристаллов, после чего добавьте в чашку 25 мл этанола. Поскольку полученный комплекс хорошо растворим в спирте, а сульфат калия (второй продукт реакции) практически не растворим, будет наблюдаться образование двухфазной смеси. Вакуумным фильтрованием отделите жидкую фазу, содержащую комплекс от осадка сульфата калия. Осадoк отбросьте, а фильтрат упарьте в фарфоровой чашке при умеренном нагревании и затем охладите в бане со льдом. Выпавшие кристаллы отделите вакуумным фильтрованием от маточного раствора и высушите на воздухе. Рассчитайте выход комплексной соли. Идентификация темные кристаллы с сильным блеском, в отраженном свете красно-фиолетовые, в проходящем гранатово-красные. Опыт 7. Синтез гексанитрокобальтата (III) натрия Na 3 [Co(NO 2 ) 6 ] Оборудование весы, газовая горелка, треножник с асбестовой сеткой Посуда термостойкие химические стаканы, стеклянные палочки, воронка Бюхнера, водоструйный насос, чашка Петри, бюксы
18 Реактивы шестиводный хлорид кобальта CoCl 2 6Н 2 О или нитрит кобальта, уксусная кислота, гидроксид натрия Растворите в 10 мл воды 10 г шестиводного CoCl 2 или соответствующее количество нитрита кобальта. В другом стакане растворите 30 г нитрита натрия в 100 мл воды при умеренном нагревании. Растворы охладите, слейте вместе, осторожно перемешайте и прилейте 10 мл 50%-й уксусной кислоты (работать под тягой!). Образуется раствор гексанитритокобальтата (III) натрия. Смеси дайте постоять для формирования осадка, затем раствор отфильтруйте. Гексанитрокобальтат (III) натрия тонкий желтый порошок, устойчив на воздухе, хорошо растворим в воде, нерастворим в органических растворителях (спирте и эфире). Водный раствор также устойчив. Идентификация. Подействуйте несколькими каплями полученного раствора на соль калия: образуется желтый осадок: реактив на ион калия. При кипячении со щелочью выделяется Co(OH) 3. Опыт 8. Синтез хлорида хлоропентаамминокобальта (III)[CoCl(NH 3 ) 5 ]Cl 2 Оборудование Посуда Реактивы весы, газовая горелка, треножник с асбестовой сеткой, термостойкие химические стаканы, воронка Бюхнера, водоструйный насос, чашка Петри, бюксы шестиводный CoCl 2, хлорид аммония, аммиак, пероксид водорода, концентрированная соляная кислота, этанол Растворите 10 г шестиводного CoCl 2 в минимальном количестве воды и 20 г хлорида аммония в 60 мл концентрированного (25%) водного раствора аммиака. Затем слейте эти растворы и добавляйте к полученной смеси 15 мл пероксида водорода (30%) порциями по 2-3 мл. После окончания окисления раствор нейтрализуйте соляной кислотой (конц.), нагрейте все до кипения и оставьте на холоде. Выпавший осадок отфильтруйте, а затем растворите в 2% водном растворе аммиака. Еще горячий раствор отфильтруйте, а затем фильтрат подкислите соляной кислотой и прокипятите. Выпавший осадок после охлаждения отфильтруйте, промойте водой, спиртом и высушите. Рассчитайте выход комплексной соли. Идентификация. Внешний вид продукта: кристаллы пурпурного цвета. После выполнения экспериментальной части: — Укажите состав внешней и внутренней сферы. — Определите степень окисления металла-комплексообразователя; дентатность лиганда; заряд комплексного иона.
19 — Проведите и запишите уравнение качественной реакции на хлорид-ион. Составьте структурную формулу. — С точки зрения метода валентных связей приведите схему образования химической связи в комплексной частице. -Определите тип гибридизации атомных орбиталей комплексообразователя. — Запишите уравнение диссоциации комплекса. -Укажите константу устойчивости комплекса. Предложите реакции обмена лигандами и реакции разрушения комплекса. Выведите формулу для расчета констант равновесия предлагаемых процессов. При выполнении данных опытов вам пригодятся знания, полученные в 1 семестре тема «Химическая связь», «Растворы», «Химическое равновесие», «Комплексные соединения». Работа 4. Синтез неорганических веществ Цель: освоение методов синтеза некоторых неорганических соединений Опыт 1. Получение манганата калия из раствора Оборудование весы, водяная баня со льдом Посуда термостойкая коническая колба, воронка Бюхнера, водяной насос, Реактивы перманганат калия, гидроксид калия В коническую колбу поместите 5 г перманганата калия, 15 г гидроксида калия и 25 мл воды; кипятите полученный раствор и по мере выкипания, доливайте воду. После приобретения раствором зеленой окраски, охладите при низкой температуре (лед). В осадок выпадают темно-зеленые кристаллы. Отфильтруйте на воронке Бюхнера, промойте холодным раствором щелочи и высушите. На воздухе соль достаточно устойчива. — Напишите уравнение реакции, составьте уравнение электронного баланса, выпишите соответствующие полуреакции, укажите значения стандартных потенциалов, рассчитайте ЭДС. — Укажите степень окисления марганца, предскажите окислительновосстановительные свойства вещества. Докажите свои предположения экспериментально.
20 Опыт 2. Получение манганата калия сплавлением Оборудование весы, газовая горелка Посуда термостойкая пробирки, пробиркодержатель термостойкие химические стаканы, Реактивы диоксид марганца, хлорат калия, нитрат калия, гидроксид калия Поместите в пробирку смесь из 4 г хлората калия (или нитрата калия), 10 гранул гидроксида калия и 0,2 г диоксида марганца. Пробирку закрепить в пробиркодержателе и содержимое пробирки расплавить на пламени горелки. Расплав окрашивается в зеленый цвет в результате образования манганата калия. Горячую пробирку опустить в стакан, содержащий 2н раствор щелочи. Полученный раствор использовать для проведения дальнейших исследований. — Составьте уравнения проведенных химических процессов. — Укажите степень окисления марганца, предскажите окислительновосстановительные свойства вещества. Докажите свои предположения экспериментально, используя реактивы, имеющиеся в лаборатории. — Используя диаграмму Латимера, оцените склонность манганатов к диспропорционированию. Рассчитайте константы равновесия реакций: 3MnO H 2 O = 2MnO MnO 2 + 4OH — (1) 3MnO H + = 2MnO MnO 2 + 2H 2 O (2) и сделайте вывод о сравнительной устойчивости манганатов в нейтральной и кислой средах при стандартных условиях. — На основании полученных результатов, укажите, какая среда должна быть в растворе манганата калия, чтобы этот раствор был устойчив в лабораторных условиях. Выполнение данной работы будет успешным, если студенты воспользуются ранее изученным материалом по теме «Окислительновосстановительные процессы». Опыт 3. Получение перлов буры Оборудование Посуда Реактивы газовая горелка стеклянные палочки с впаянной платиновой проволокой, фарфоровые чашки бура Na 2 B 4 O. 7 10H 2 O, растворы нитратов кобальта (II), хрома (III), железа (III)
21 В ушко платиновой проволоки поместите небольшое количество буры и нагрейте в пламени горелки, при этом непрерывно вращайте стеклянную палочку, чтобы расправленная бура не скапывала с нее. При нагревании бура теряет кристаллизационную воду, происходит вспенивание, а затем образование стекловидной прозрачной массы (образование перла). Полученным перлом коснуться раствора одной из солей и прокалить в пламени горелки. При нагревании нитраты металлов разлагаются с образованием соответствующих оксидов. Оксиды растворяются в расплавленной буре и окрашивают перл в соответствующий цвет. После охлаждения осторожно снять (стряхиванием в фарфоровую чашку) с платиновой проволоки полученный перл. — Составьте уравнения термического разложения буры, нитратов солей, взаимодействия оксидов металлов с бурой. — Отметьте окраску перлов в зависимости от природы нитратов солей. Опыт 4. Получение хлорида меди (I) Оборудование Посуда Реактивы весы коническая колба с клапаном Бунзена, пинцет, воронка Бюхнера, водяной насос, бюкс хлорид меди (II), кусочки металлической меди, соляная кислота, спирт Приготовьте насыщенный раствор хлорида меди (II), добавьте небольшое количество соляной кислоты и поместите кусочки меди. Закройте колбу пробкой с клапаном Бунзена. Через несколько дней на дне колбы образуется осадок хлорида меди (I). Металлическую медь удалите пинцетом. Осадок отфильтруйте, промойте водой, спиртом, эфиром и высушите. Хранить продукт нужно в бюксе. — Напишите уравнение реакции, составьте уравнение электронного баланса, выпишите соответствующие полуреакции, укажите значения стандартных потенциалов, рассчитайте ЭДС. — Предскажите свойства полученного соединения. Подтвердите их экспериментально, используя реактивы, имеющиеся в лаборатории. — Предложите альтернативные способы получения. Результаты данного эксперимента пригодятся студентам при изучении темы «Медь и ее соединения» во 2 семестре.
22 Опыт 5. Получение роданида ртути («фараоновы змеи») Посуда химические стаканы, водяной нанос, воронка Бюхнера, фильтровальная бумага Реактивы нитрат ртути (II), роданид калия, азотная кислота (2 н) Приготовьте концентрированные растворы нитрата ртути (II) (7г) и роданида калия (2 г). Для предупреждения гидролиза в раствор нитрата ртути прилейте небольшое количество азотной кислоты. Слейте растворы веществ и наблюдайте образование осадка (соотношение реагирующих веществ приблизительно 3:1 по массе). Выпавший садок отфильтруйте на воронке Бюхнера, промойте на фильтре несколько раз водой. Часть осадка смешайте с небольшим количеством крахмального клейстера. Каждую часть осадка поместите на фильтровальную бумагу, сформируйте образцы цилиндрической формы и высушите на воздухе. Храните в плотно закрытой склянке. При температуре 165 о С роданид ртути разлагается, продукты разложения занимают объем, значительно превышающий объем исходной соли. По внешнему виду разложение этого вещества имеет сходство с движущимися змеями, отсюда и название «фараоновы змеи». — Напишите уравнение реакции получения роданида ртути (II) и исследуйте его термическую устойчивость. — Какие правила по технике безопасности необходимо соблюдать при проведении эксперимента? Результаты данного эксперимента пригодятся студентам при изучении темы «Ртуть и ее соединения» во 2 семестре. Опыт 6. Приготовление смеси для «бенгальских огней» Оборудование Реактивы газовая горелка, керамические плитки, 4 фарфоровые ступки стеклянная длинная палочка, один конец которой обмотан ватой «зажигалка», сера, уголь, хлорат калия, спирт, нитраты стронция и бария В фарфоровых ступках тщательно растереть (измельчить) каждое из исходных веществ. Все исходные компоненты должны быть сухими и хорошо перемешаны. Каждая смесь хранится в отдельной склянке, хорошо закрытой. Для демонстрации горения «бенгальских огней», компоненты смеси отдельно перемешивают, помещают на керамическую плитку,
23 поджигают с помощью «зажигалки» смоченной спиртом. Реакция протекает со вспышкой. Пламя окрашивается в соответствующий цвет. Состав «огней»: Красный 4г KClO г S + 2г C + 33г Sr(NO 3 ) 2 Зеленый 9г KClO г S + 3гC+ 31г Ba(NO 3 ) 2 — Составьте уравнения химических реакций, которые могут происходить при горении «бенгальских огней». При выполнении эксперимента используйте знания по изучению «Окислительно-восстановительных процессов». Опыт 7. Получение основных карбонатов меди, цинка, свинца Цель: изучить способы получения основных солей и их свойства Оборудование весы, газовая горелка, пробиркодержатели, пробирки Посуда химические термостойкие стаканы, водяной насос, воронка Бюхнера, стеклянные палочки для перемешивания растворов, чашки Петри, бюксы Реактивы растворимые соли меди, свинца, цинка, карбонат натрия, соляная (серная) кислота, Прежде чем приступить к выполнению эксперимента, выясните у преподавателя, какое количество по массе основного карбоната вам необходимо получить. Рассмотрите различные способы получения основных солей. Используя растворы солей меди (или цинка, свинца) и карбоната натрия получите основные карбонаты. — Рассчитайте необходимое для проведения синтеза массу соли и карбоната. — В какой последовательности необходимо сливать реагирующие компоненты? — Используемые растворы должны быть концентрированными или разбавленными? Образовавшийся осадок отфильтруйте на воронке Бюхнера. Высушите в чашке Петри на воздухе. Рассчитайте практический выход соли от теоретически возможного. — Объясните, почему продуктом реакции является образование основного карбоната, а не соответствующих гидроксидов или карбонатов меди, цинка, свинца? — Исследуйте: термическую устойчивость продуктов и основные свойства (отношение к кислотам).
24 — Напишите соответствующие уравнения химических превращений и укажите признаки химических реакций. Для обоснованного ответа используйте таблично-справочные данные. При выполнении эксперимента используйте знания, (о произведении растворимости (ПР); гидролизе солей; факторах, влияющих на процесс гидролиза; реакциях ионного обмена; правилах образования и растворения осадков) которые были получены в 1 семестре. Опыт 8. Приготовление окислительно-восстановительной смеси «черного пороха» Оборудование аппарат Киппа с мрамором и соляной кислотой Посуда Термостойкий химический стакан, длинная стеклянная палочка, длинная лучина Реактивы нитрат калия, сера, уголь Исходные компоненты тщательно разотрите в фарфоровой ступке, каждое по отдельности и поместите в сухие, плотно закрывающиеся бюксы или склянки с притертыми пробками. Смесь готовят путем тщательного перемешивания сухих тонко измельченных порошков нитрата калия, серы и угля. Приготовьте смесь из 16 г нитрата калия с 2 г серы и 2 г угля. Половину этой смеси поместите на керамическую плитку и подожгите с помощью длинной лучины. Смесь вспыхивает и быстро сгорает. Вторую половину смеси поместите на кусок асбеста, находящегося на дне большого термостойкого стакана. Наполните стакан углекислым газом из аппарата Киппа. Накалите конец стеклянной палочки в пламени горелки и поднесите к смеси на дне стакана. Смесь сгорает так же, как и на воздухе. Т.е. полученная смесь горит в атмосфере углекислого газа. — Напишите уравнение химического процесса. Где используется такая смесь? — За счет чего происходит процесс горения смеси? При выполнении работы, используйте знания об окислительновосстановительных свойствах химических соединений, полученных ранее.
25 Работа 5. Адсорбция как способ разделения смесей и очистки веществ Цель: изучение адсорбции твердыми адсорбентами, проверка адсорбционной способности активированного угля Оборудование Посуда Реактивы весы штатив с пробирками, воронки, колбы, стеклянная трубочка длиной около 10 см и диаметром 5-6 мм, пипетка на 10 и 50 мл, мерная пробирка, бюретки сероводородная вода, раствор индиго, раствор йода, раствор нитрата свинца, фильтровальная бумага, раствор йодида калия, водный и спиртовой раствор фуксина одинаковой концентрации, растворы солей меди (II), кобальта (II) и железа (III), оксид алюминия, фенолфталеин, раствор гидроксида натрия 0,1 н активированный уголь, растворы уксусной кислоты 0,1 н и 0,05 н. Опыт 1. Адсорбция углем различных веществ из растворов (демонстрация на лекции) Налейте в пробирку сероводородную воду, в другую пробирку раствор индиго, в третью раствор йода. В каждую пробирку всыпьте по 0,2 г активированного угля, перемешайте и отфильтруйте. — Отметьте наблюдаемые изменения запаха и цвета. — Объясните наблюдаемые явления. Опыт 2. Адсорбция ионов свинца углем (демонстрация на лекции) В две пробирки налейте по 5 мл 0,05%-ного раствора нитрата свинца. В одну пробирку добавьте небольшое количество раствора йодида калия для доказательства ионов свинца в растворе. В другую пробирку добавьте 0,2 г активированного угля и взбалтывайте в течение 5 мин. Отфильтруйте раствор и проверьте присутствие ионов свинца, используя качественную реакцию. — Напишите уравнение качественной реакции и объясните наблюдаемое явление. — Дайте определение понятия адсорбция? — Какой вид адсорбции происходит в данном случае: физическая и химическая адсорбция?
26 Опыт 3. Влияние природы растворителя на адсорбцию (демонстрация на лекции) В одну пробирку налейте 5 мл слабоокрашенного водного раствора фуксина, в другую такое же количество спиртового раствора. В обе пробирки внесите по 0,2 г активированного угля и взбалтывайте в течение 5 мин. Отфильтруйте растворы. — Почему в одном случае адсорбция идет хорошо, в другом плохо? Опыт 4. Хроматографическое разделение солей (демонстрация на лекции) В качестве адсорбента в опыте используется оксид алюминия Al 2 O 3. Стеклянную трубочку длиной около 10 см и внутренним диаметром 5-6 мм закройте с одного конца пробочкой из фильтровальной бумаги, заполните ее оксидом алюминия высотой около 5 см. Налейте в небольшую пробирку по 5-6 капель 0,5 н растворов солей Cu 2+, Co 2+, Fe 3+ и опустите в смесь солей трубку, заполненную оксидом алюминия. При капиллярном поднятии раствора в трубку ионы солей избирательно адсорбируются на поверхности зерен оксида алюминия и распределяться в виде окрашенных слоев по высоте адсорбента. — Зная, в какой цвет окрашены исходные растворы солей, укажите, в каком порядке эти соли адсорбируются из раствора. Опыт 5. Адсорбция уксусной кислоты В три чистые, сухие и пронумерованные колбы внесите по 1 г активированного угля. С помощью пипетки внесите в колбы по 50 мл уксусной кислоты следующих концентраций: в первую 0,2 н; во вторую = 0,1 н, в третью 0,5 н. Закройте колбы пробками и перемешивайте содержимое в течение 20 мин. Отфильтруйте растворы в отдельные пронумерованные колбы. 10 мл каждого фильтрата поместите в отдельные колбы, добавьте по капле фенолфталеина и оттитруйте раствором 0,1 н гидроксида натрия. Для этого раствор гидроксида натрия необходимо налить в бюретку и титровать им до бледно-розового окрашивания растворов в колбах с уксусной кислотой. Запишите количество израсходованного раствора гидроксида натрия в первом, втором и третьем случаях. Объем исследуемого раствора Объем раствора гидроксида уксусной кислоты, мл натрия, израсходованного на титрование, мл 1-й раствор — 10 мл
5 способов снизить температуру без лекарств
Высокая температура – частый симптом таких распространенных заболеваний, как ОРВИ, ангина, пневмония. Чтобы снизить жар и облегчить состояние больного, врачи рекомендуют принимать жаропонижающие средства, однако это не всегда возможно. Слишком частое употребление данных препаратов может привести и к аллергическим реакциям, и к передозировке – отравлению. Случается также, что жаропонижающих средств попросту нет в доме. В подобных ситуациях стоит воспользоваться немедикаментозными, но оттого не менее эффективными способами снижения температуры. Вот несколько из них.
Обтирание
Чтобы снизить температуру у больного, смачивают губку или полотенце в прохладной воде, отжимают и осторожно обтирают туловище, лицо, конечности. Капелькам жидкости, оставшимся на коже, дают высохнуть самостоятельно. Для усиления эффекта в воду добавляют несколько капель столового уксуса либо водку в пропорции 1:1. Детей лучше обтирать водой комнатной температуры (в противном случае процедура может спровоцировать шок и фебрильные судороги, вызванные спазмом сосудов).
Процедура обтирания водой, даже водой комнатной температуры, дает эффект снижения жара на 1-2 градуса в течение 1-1,5 часа.
 Источник: depositphotos.com
Источник: depositphotos.com Прикладывание льда
Для снижения температуры лед раскалывают на небольшие кусочки, складывают в полиэтиленовый пакет и прикладывают к местам проекции крупных сосудов: ко лбу, к подмышечным областям, паховым складкам, подколенным ямкам. Чтобы защитить больного от переохлаждения, между кожей и льдом надо проложить свернутое хлопчатобумажное полотенце. Прикладывание льда лучше не продолжать более 5-7 минут; через четверть часа процедуру можно повторить.
 Источник: depositphotos.com
Источник: depositphotos.com Прохладная клизма
Жаропонижающая клизма – малоприятная процедура, которую рекомендуется проводить, если все остальные способы снижения температуры неприемлемы или не дали ощутимых результатов. Для этих целей используют теплую воду, как правило, на 2 градуса ниже, чем температура тела в данный момент, с солью (из расчета ½ ч. л. на 100 мл воды). Количество жидкости для клизмы зависит от возраста больного:
- 1 год – 120 мл;
- 2 года – 200 мл;
- 5 лет – 500 мл;
- старше 10 лет – 1 л.
Все вышеперечисленные физические методы снижения температуры тела (обтирания прикладывание льда, клизма) противопоказаны детям до года – особенно со склонностью к судорогам, пороками сердца. Кроме того, данные процедуры запрещается использовать при холодной гипертермии (ознобе, ледяных конечностях, синюшном цвете кожи) – в этом случае они только усугубят состояние больного.
 Источник: depositphotos.com
Источник: depositphotos.com Обильное питье
Обильное питье при высокой температуре тела рекомендуется для того, чтобы больному было чем потеть – а пот, как известно, обладает высоким охлаждающим действием. При таком питьевом режиме активизируется выведение токсинов, вовремя восполняются теряемые при потении запасы жидкости. При лечении ОРВИ рекомендуется употреблять напитки, богатые витамином С: отвар из шиповника, сухофруктов, клюквенный морс, чай с лимоном, апельсиновый сок. Усиливает потоотделение чай с малиновым вареньем и другими антипиретиками, однако перед его употреблением следует выпить еще что-либо. Напитки нужно пить медленно, мелкими глотками, чтобы не вызвать рвоту. При чувстве жара питье должно быть теплым (около 30 °C), а при ознобе – горячим. Чтобы организму было куда отдавать тепло, воздух в комнате должен быть прохладным (не более 18 °C).
 Источник: depositphotos.com
Источник: depositphotos.com Натуральные антипиретики (жаропонижающие)
Натуральными антипиретиками являются плоды и растения, обладающие жаропонижающими свойствами.
Первая группа таких растений содержит входящую в состав аспирина салициловую кислоту, только в меньшей концентрации. Это клубника, малина, вишня, черная и красная смородина, чернослив, апельсины. Употреблять ягоды и фрукты можно в любом виде, но лучше в качестве морсов и варенья, добавленного в чай.
Вторая группа антипиретиков – растения с потогонным эффектом: душица, березовые почки, календула, липовый цвет. Из них лучше приготовить отвар: 2 ст. л. сухого сырья залить 200 г кипятка и настаивать в течение 2 часов.
Обычный мед тоже является антипиретиком, причем он и содержит салициловую кислоту, и дает потогонный эффект. Кроме того, мед укрепляет иммунитет, тем самым обеспечивая антибактериальный и противовирусный эффект.
Любые натуральные антипиретики следует употреблять с осторожностью, так как все они способны вызывать аллергию.
 Источник: depositphotos.com
Источник: depositphotos.com И в заключение стоит отметить, что снижение жара немедикаментозными средствами разрешено в качестве мер экстренной помощи либо в случае не поддающейся препаратам стойкой гипертермии. Однако снижение температуры не исключает обращения к врачу для назначения лечения.
Видео с YouTube по теме статьи:
Ученые смогли охладить вещество ниже температуры абсолютного нуля | Наука
Ученым удалось совершить нечто невообразимое: они смогли охладить вещество ниже температуры, которая до сих пор считалась абсолютным минимумом. В большинстве современных учебников по физике абсолютный ноль по шкале Кельвина или минус 273,15 градусов по Цельсию считается самой низкой из возможных температур, так как при ней даже самый легкий элемент — водород — полностью теряет свою подвижность, то есть, говоря фигурально, замерзает, пишет news7.in.ua.
Как ни странно, но одним из способов изучения отрицательных температур является бесконечно сильный разогрев вещества. Этот необычный, граничащий с фантастикой, подход, позволяет в теории проектировать двигатели, КПД которых будет выше 100%, проливает свет на такие загадочные субстанции, как темная энергия и другие.
С точки зрения атомной физики, температура — это скорость. Скорость движения атомов внутри вещества, и чем быстрее атомы движутся, тем выше температура. Соответственно, при минус 273,15 градусах атомы водорода полностью останавливаются. С таким подходом, никакое вещество не может быть холоднее этого лимита.
Однако современная физика, чтобы понять сущность температуры, предлагает взглянуть на нее иначе — не как на линейный показатель, а как на петлю: положительные температуры — это одна часть цикла, отрицательные — другая. При температурах, стремящихся к бесконечно низким или бесконечно высоким, шкала рано или поздно оказывается на отрицательной области. При положительных температурах атомы чаще занимают низкие энергетические состояния, а при отрицательных — высокие. В физике подобный эффект известен, как распределение Больцмана.
При абсолютном нуле атомы занимают самое низкое энергетическое состояние, а при «бесконечной температуре» атомы могут занимать сразу все энергетические состояния. Соответственно, при очень высоких температурах они занимают все высокие энергические состояния, а при очень низких температурах — все низкие.
«Говоря о низкой температуре, можно говорить, что мы имеем дело с перевернутым распределением Больцмана», — говорит физик Ульрих Шнайдер из Мюнхенского университета в Германии. «С такой логикой, вещество, достигающее температуры ниже абсолютного нуля, становится горячим. Мы считаем, что при достижении рубежа в минус 273 градуса температура не заканчивается, а просто переходит к отрицательным значениям».
Как несложно предположить, объекты с отрицательной температурой ведут себя очень странно. К примеру, обычно энергия, исходящая от объекта с более высокой температурой, всегда будет больше, чем от более прохладного объекта. Однако если вещество переходит на отрицательную шкалу, то там чем оно холоднее, тем больше энергии излучает. Таким образом, здесь более холодный объект всегда будет более энергетически активен, нежели более теплый.
Другим странным последствием отрицательных температур является энтропия — показатель того, насколько вещество является упорядоченным. Когда объект имеет традиционную температуру, он увеличивает энтропию вещества вокруг и внутри себя, но когда температуры уходит в отрицательную зону, бесконечно «холодно/горячий» объект способен снижать энтропию внутри и вокруг себя.
Немецкие физики говорят, что отрицательная температура — это пока в значительной мере теория. Но она станет практикой, когда наука научится работать с четкими энергетическими показателями одного отдельно взятого атома вещества. Когда исследователи смогут работать с одним отдельным атомом подобно тому, как с объектами в макромире, можно будет говорить о том, смогут ли атомы охлаждаться до супернизких температур или могут ли они лететь быстрее скорости света.
Пока же для генерации отрицательных температур ученые создали систему, в которой атомы имели жесткий предел того, какой энергией они могут обладать. Для этого физики взяли 100 000 атомов и охладили их до температуры в одну миллиардную градуса Кельвина. Атомы были охлаждены в вакуумной камере, изолированной от внешней среды. Для точного контроля атомов исследователи применяли сеть лазерных лучей и магнитных полей.
По словам ученых, температура вещества в конечном итоге зависит от того, сколько потенциальной энергии есть у атома и сколько энергии образуется от взаимодействия между атомами. Кроме того, температура также тесно связана с давлением — чем горячее объект, тем больше он расширяется и наоборот. Чтобы убедиться в том, что газ может иметь температуру ниже абсолютного нуля, нужно было создать такие условия, в которых сами атомы не имели бы существенной энергии, а от отталкивания атомов образовывалось бы больше энергии, чем от их притяжения.
Нечто подобное получилось воссоздать на наномасштабе. Симон Браун из Мюнхенского университета говорит, что в будущем на практике такие знания могут привести к созданию сверхэффективных тепловых двигателей. Работа таких двигателей опирается на преобразование тепловой энергии в механическую. Теоретически, с отрицательными температурами такие двигатели могли бы иметь КПД выше 100%, хотя с точки зрения логики это кажется невозможным.
Воду переохладили до рекордно низкой температуры

Перисто-кучевое облако, сформировавшееся в результате кристаллизации льда из сильно переохлажденных капель воды
Ian Jacobs / flickr
Физикам впервые удалось переохладить водные капли до −42,55 градуса Цельсия, что более чем на градус ниже предыдущего подтвержденного рекорда. Для охлаждения использовался метод быстрого вакуумного испарения, а температура определялась по данным комбинационного рассеяния света, исходя из размера капель, сообщают ученые в Physical Review Letters.
При охлаждении воды в неравновесных условиях, она может оставаться в жидком состоянии даже при температурах значительно ниже температуры плавления (то есть нуля градусов Цельсия). Такая вода называется переохлажденной и для ее получения необходимо отсутствие в ней центров кристаллизации. Переохладить воду больше, чем на несколько градусов, достаточно сложно, поэтому все экспериментальные рекорды по получению самой холодной жидкой воды известны для очень чистых микрокапель, которые не контактируют с твердыми поверхностями.
К настоящему моменту самая низкая температура, при которой микрокапли воды удавалось сохранить в жидком состоянии и которую при этом удалось измерить достоверно, составляла примерно −41 градус Цельсия (стоит отметить, что капли воды, переохлажденные до −39 градусов Цельсия можно встретить и в естественных условиях в облаках в верхних слоях атмосферы). При этом по результатам теоретического анализа и компьютерного моделирования известно, что минимальная температура, при которой вода все еще может существовать в метастабильном жидком состоянии, составляет около −45 градусов, ниже которой переохлажденное состояние уже является неустойчивым.
Коллектив физиков из Германии, Франции, Испании и Италии под руководством Роберта Гризенти (Robert E. Grisenti) из Франкфуртского университета имени Гёте предложил использовать для переохлаждения микрокапель воды метод быстрого испарения в вакууме. Основной недостаток этого подхода состоит в том, что при таком охлаждении достаточно сложно точно определить температуру. Чтобы решить эту проблему, авторы работы предложили использовать метод комбинационного рассеяния света. Измерив смещение рамановского пика по частоте, можно с очень хорошей точностью определить распределение капель в струе по размеру, исходя из которого затем рассчитать потерю массы при испарении и после этого — температуру капли. Точность такого метода, по оценкам ученых, составляет около 0,5 градуса.
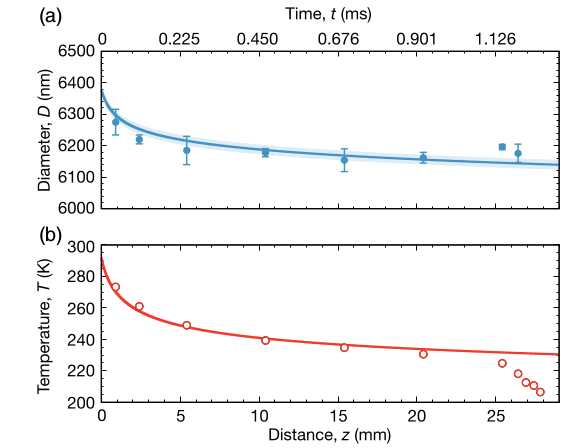
Данные об изменении размера (сверху) и температуры (снизу) капли при сверхбыстром испарении в вакууме. Крайние правые символы соответствуют каплям, в которых уже началась кристаллизация льда
Claudia Goy et al./ Physical Review Letters, 2018
С помощью предложенного подхода ученым удалось охладить капли, начальный размер которых составлял около 6,3 микрон, до температуры −42,55 градуса Цельсия, что даже с учетом довольно большой погрешности примерно более чем на градус ниже предыдущего рекорда, определенного достоверным методом измерения. Авторы работы отмечают, что в одной из работ уже писали о переохлаждении капель даже большего размера до таких же температур, как и в данной работе, однако, по всей видимости, авторы предыдущего исследования не учли возможное нагревание капель в результате облучения. Надежность метода измерений температуры, предложенного в данной работе, еще предстоит проверить.Ученые сообщают, что предложенный метод позволяет охлаждать и более крупные капли до достаточно низких температур. Кроме того, метод комбинационного рассеяния одновременно с размером капли дает возможность следить и за состоянием связи между кислородом и водородом внутри молекул и водородных связей между молекулами. Исходя из полученных данных, в будущем ученые надеются получить информацию об изменении структуры водородных связей в воде при переохлаждении до критически низких температур. По словам авторов исследования, результаты работы, в частности, помогут более детально изучить процессы, происходящие при кристаллизации льда в атмосфере, и построить более надежные климатические модели.
Поскольку скорость кристаллизации льда из переохлажденной воды очень велика, экспериментальное исследование этого процесса тоже довольно затруднительно. Чтобы наблюдать за фронтом кристаллизации, ученые, в частности, используют облучение короткими лазерными импульсами полутяжелой воды. С помощью такого метода американские физики описали кристаллизацию льда из воды, переохлажденной до температур от −90 до −10 градусов Цельсия и показали, что скорость роста кристалла в зависимости от температуры может отличаться на 11 порядков.
Александр Дубов
"Питер - АТ"
ИНН 780703320484
ОГРНИП 313784720500453












