Принцип работы аккумуляторной батареи
Принцип работы аккумулятора
Разность потенциалов, возникающая при погружении двух пластин в раствор с электролитом, составляет основной принцип работы аккумулятора. Для того, чтобы понять, как работает аккумуляторная батарея, необходимо знать ее устройство.
Устройство аккумуляторной батареи
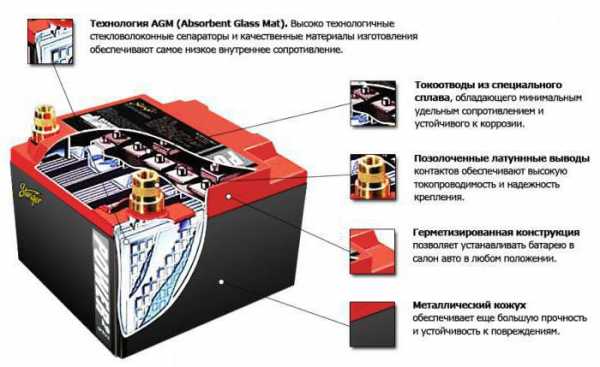
Аккумулятором называется отдельно взятая ячейка, которая в соединении с другими подобными ячейками образует аккумуляторную батарею. В стандартной 12-ти вольтовой батарее объединены шесть аккумуляторов, вырабатывающих напряжение 2 вольта каждый. Все они заключены в общий корпус, обеспечивающий целостность всей конструкции.
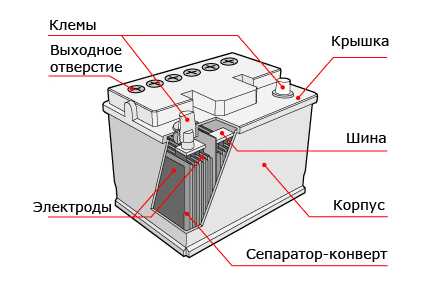
Жесткие требования к корпусу связаны с необходимостью устойчиво переносить колебания температур, агрессивные химические воздействия, а, также, вибрацию. Основным материалом корпуса является полипропилен. В состав корпуса входят две части: основная емкость с большой глубиной, которая закрывается крышкой, оснащенной отверстиями с пробками либо дренажной системой.
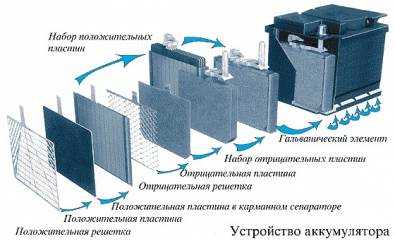
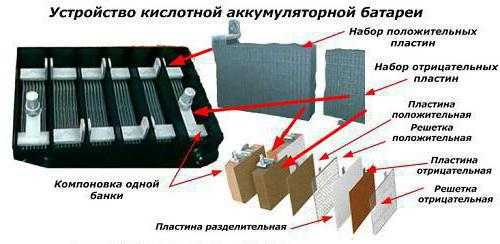
В каждой ячейке устанавливается пакет собранный из свинцовых пластин с чередующейся полярностью. На их решетчатую конструкцию наносится активная масса, являющаяся рабочим реагентом. Такие пластины в обязательном порядке применяются в автомобильных аккумуляторах.
Для предотвращения замыкания, между пластинами вставляются сепараторы, материалом для которых служит пористый пластик. После сборки пакет фиксируется с помощью специального бандажа для предотвращения деформации и смещения. К плюсовым и минусовым выводам тока на пластинах подключаются клеммы приема тока.
Принципы работы
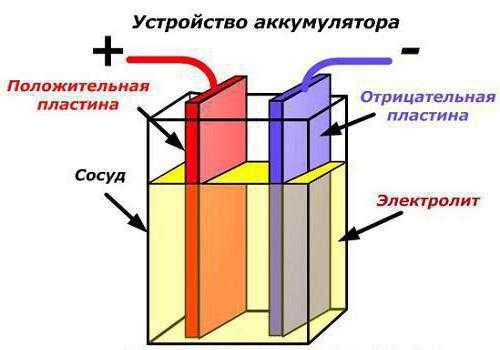
Принцип работы аккумулятора основан на реакции между двуокисью свинца положительной пластины, губчатым свинцом отрицательной пластины и раствором серной кислоты с водой. Этот раствор представляет собой электролит, плотность которого составляет 1,28 г/см3. Происходит образование электрического тока, с одновременным образованием на отрицательной пластине сульфата свинца. Происходит выделение воды из электролита, со снижением его плотности.
При поступлении электрического тока из внешних источников, таких как генератор или зарядное устройство, электрохимический процесс начинает происходить в обратном направлении. На отрицательных электродах происходит восстановление чистого свинца, а на положительных – регенерируется диоксид свинца. Одновременно повышается плотность электролита.
Таким образом, принцип работы аккумулятора основан на методе двойной сульфатации, позволяющей полностью восстанавливать первоначальные свойства батареи. Срок службы аккумулятора напрямую зависит от качества используемых материалов.
Устройство и неисправности свинцовых аккумуляторов
Механизм работы аккумулятора
Аккумуляторы — это химические источники тока с обратимым процессом: они могут отдавать энергию, преобразуя химическую энергию в электрическую, или накапливать энергию, преобразуя электрическую энергию в химическую. Таким образом, аккумулятор попеременно то разряжается, отдавая электрическую энергию, то заряжается от какого-либо соответствующего источника постоянного тока.
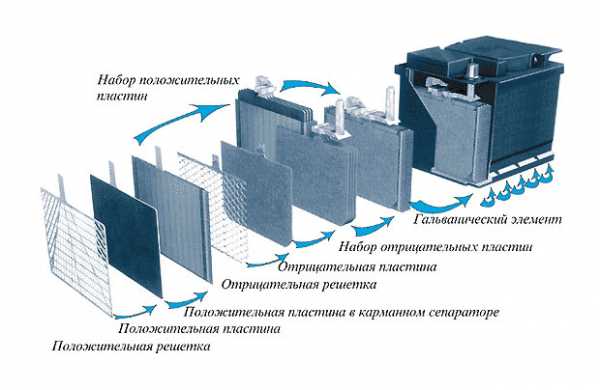
Схема сборки аккумулятора.
Аккумуляторы, в зависимости от применяемого в них электролита, подразделяются на кислотные и щелочные. Кроме того, аккумуляторы различаются, в зависимости от материала электродов. Широкое применение имеют лишь свинцовые, кадмиево-никелевые, железо-никелевые и серебряно-цинковые аккумуляторы.
Емкость аккумулятора определяется количеством электричества qp, которое он может отдать при разряде в питаемую цепь.
Это количество электричества измеряется не в кулонах, а в более крупных единицах — ампер-часах (а-ч). 1 а-ч = 3600 кл. Но для заряда аккумулятора требуется большее количество электричества q3, чем отдаваемое при разряде. Отношение qp : q3 =ne называется отдачей аккумулятора по емкости.
Напряжение, необходимое для заряда аккумулятора, значительно выше того напряжения на зажимах аккумулятора, при котором он отдает длительно разрядный ток.
Схема устройства аккумулятора.
Важной характеристикой аккумулятора являются его средние зарядное и разрядное напряжения.
Ясно, что из-за ряда потерь энергии аккумулятор отдает при разряде значительно меньшее количество энергии Wp, чем получает при заряде. Отношение Wp : W3= n есть коэффициент полезного действия или отдача по энергии аккумулятора.
Наконец, весьма важной для характеристики аккумулятора величиной является его удельная э н е р г и я, т. е. количество энергии, отдаваемой при разряде, приходящееся на 1 кг веса аккумулятора. Особенно существенно, чтобы удельная энергия была возможно больше у нестационарных аккумуляторов, устанавливаемых, например, на самолетах. В подобных случаях обычно она важнее, чем коэффициент полезного действия и отдача по емкости.
Следует иметь в виду, что при медленном разряде процесс в аккумуляторе протекает равномерно во всей массе пластин, благодаря чему при длительном разряде малым током емкость аккумулятора больше, чем при кратковременном разряде большим током. При быстром разряде процесс в массе пластин отстает от процесса на их поверхности, что вызывает внутренние токи и уменьшение отдачи.
Напряжение аккумулятора существенно изменяется во время разряда. Желательно, чтобы оно было возможно более постоянным. В расчетах обычно указывается среднее разрядное напряжение Up. Но для заряда аккумулятора нужен источник тока, дающий значительно большее зарядное напряжение Uз (на 25— 40%). В противном случае невозможно зарядить аккумулятор полностью.
Схема литиево-кислородного аккумулятора.
Если напряжение одного аккумуляторного элемента недостаточно для данной установки, то необходимое число аккумуляторных элементов соединяется последовательно. Конечно, последовательно соединять можно только аккумуляторы, рассчитанные на одну и ту же разрядную силу тока.
Если разрядный ток одного элемента недостаточен, то применяется параллельное соединение нескольких одинаковых элементов.
Из числа кислотных аккумуляторов практическое значение имеют лишь свинцовые аккумуляторы. В них на положительном электроде активным веществом служит двуокись свинца РЬ02, на отрицательном электроде — губчатый свинец РЬ. Положительные пластины имеют бурый цвет, отрицательные— серый, в качестве электролита применяется раствор серной кислоты h3S04 с с удельным весом 1,18—1,29.
Химический процесс разряда и заряда свинцового аккумулятора относительно сложен. В основном он сводится к восстановлению свинца на положительном электроде и окислению губчатого свинца на отрицательном электроде в закисную соль серной кислоты. При этом образуется вода и, следовательно, плотность электролита уменьшается. При разряде сначала напряжение аккумулятора быстро падает до 1,95 В, а затем медленно понижается до 1,8 В. После чего необходимо прекратить разряд.
При дальнейшем разряде имеет место необратимый процесс образования кристаллического сернокислого свинца PbS4. Последний покрывает пластины белым налетом. Он обладает большим удельным сопротивлением и почти не растворим в электролите. Слой сернокислого свинца увеличивает внутреннее сопротивление активной массы пластин. Такой процесс называется сульфатацией пластин.
При заряде аккумулятора процесс идет в обратном направлении: на отрицательном электроде восстанавливается металлический свинец, а на положительном электроде свинец окисляется до двуокиси РЬ02. Ион S04 переходит в электролит, поэтому плотность серной кислоты при заряде увеличивается, следовательно, возрастает и удельный вес электролита. Для измерения удельного веса электролита применяется специальный ареометр. По его показаниям можно ориентировочно судить, в какой мере аккумулятор заряжен. Среднее разрядное напряжение свинцового аккумулятора 1,98 В, а среднее зарядное напряжение 2,4 В.
Схема зарядки аккумулятора.
Внутреннее сопротивление rBн свинцовых аккумуляторов, благодаря малому расстоянию между пластинами и большой площади их соприкосновения с электролитом, весьма мало: порядка тысячных долей ома у стационарных аккумуляторов и сотых долей у небольших переносных аккумуляторов.
Вследствие малого внутреннего сопротивления и относительно большого напряжения КПД этих аккумуляторов достигает 70— 80 %, а отдача — 0,85—0,95 %.
Однако из-за малого внутреннего сопротивления в свинцовых аккумуляторах при коротких замыканиях возникают токи очень большой силы, что приводит к короблению и распаду пластин.
Свинцовые аккумуляторы обладают рядом существенных недостатков. Они тяжелы из-за большого веса свинца пластин, и их объем велик из-за значительного количества электролита, активно участвующего в процессе. В них неизбежен саморазряд внутренними паразитными электрическими токами с потерей заряда порядка 1 % в сутки. Наконец, они весьма чувствительны к толчкам и сотрясениям. Но их отдача и КПД значительно выше, чем у любых других аккумуляторов.
Из числа щелочных аккумуляторов широкое применение в настоящее время имеют кадмиево-никелевые, железо- никелевые и серебряно-цинковые. Во всех этих аккумуляторах электролитом служит щелочь — примерно двухпроцентный раствор едкого калия КОН или едкого натра NaOH. При заряде и разряде этот электролит почти не претерпевает изменений. Следовательно, от его количества емкость аккумулятора не зависит. Это дает возможность свести к минимуму количество электролита во всех щелочных аккумуляторах и таким путем существенно их облегчить.
Остовы положительной и отрицательной пластин этих аккумуляторов делаются из стальных никелированных рамок с пакетами для активной массы. Благодаря такой конструкции активная масса прочно удерживается в пластинах и не выпадает при толчках.
Схема устройства пластин свинцового аккумулятора.
В кадмиево-никелевом КН аккумуляторе активным веществом положительного электрода служат окислы никеля, смешанные для увеличения электропроводности с графитом; активным веществом отрицательного электрода является губчатый металлический кадмий Cd. При разряде на положительном электроде расходуется часть активного кислорода, содержащегося в окислах никеля, а на отрицательном электроде окисляется металлический кадмий. При заряде обратно обогащается кислородом положительный электрод: гидрат закиси никеля Ni(OH)2 переходит в гидрат окиси никеля Ni(OH)3. На отрицательном электроде гидрат закиси кадмия восстанавливается в чистый кадмий. Приближенно процесс в этом аккумуляторе может быть выражен химической формулой:
разряд
2Ni (ОН)3 + 2КОН + Cd ??2Ni (ОН)2 + 2КОН + Cd (ОН)2.
заряд
Как показывает формула, из электролита при разряде выделяется частица (ОН)2 на отрицательной пластине и такая же частица переходит в электролит на положительной пластине. При заряде процесс идет в обратном направлении, но в обоих случаях электролит не изменяется.
Устройство железо-никелевого аккумулятора отличается лишь тем, что в нем в отрицательных пластинах кадмий заменен мелким порошком железа (Fe). Химический процесс этого аккумулятора можно проследить по вышеприведенному для кадмиево-никелевого аккумулятора уравнению путем замены Cd на Fe.
Применение железа вместо кадмия удешевляет аккумулятор, делает его более прочным механически и увеличивает срок его службы. Но с другой стороны, у железо-никелевого аккумулятора при том же примерно разрядном напряжении зарядное напряжение на 0,2 В выше, вследствие чего КПД этого аккумулятора ниже, чем кадмиево-никелевого. Затем очень важным недостатком железо-никелевого аккумулятора является относительно быстрый саморазряд. У кадмиево-никелевого аккумулятора саморазряд мал, и поэтому ему отдается предпочтение в тех случаях, когда аккумулятор должен длительно находиться в заряженном состоянии, например для питания радиоустановок. Среднее разрядное напряжение обоих этих аккумуляторов равно 1,2 В.
Схема железоникелевого аккумулятора.
Герметически закрытые сосуды вышеописанных щелочных аккумуляторов выполняются из листовой никелированной стали. Болты, через которые пластины аккумуляторов соединяются с внешней целью, пропускаются через отверстия в крышке сосуда, причем болт, с которым соединены отрицательные пластины, тщательно изолирован от стального корпуса; но болт, соединенный с положительными пластинами, от корпуса не изолируется.
Внутреннее сопротивление щелочных аккумуляторов значительно больше, чем кислотных, благодаря этому они лучше переносят короткие замыкания. Но по той же причине КПД щелочных аккумуляторов (порядка 45%) значительно ниже, чем кислотных, также существенно меньше их удельная энергия и отдача по емкости (0,65). Так как состояние электролита у щелочных аккумуляторов при работе не изменяется, то определить их степень заряженности по внешним признакам нельзя. Вследствие чего за зарядом приходится следить на основании их емкости и напряжения. При заряде нужно сообщить аккумулятору количество электричества It=q значительно большее, чем его емкость, примерно в 1,5 раза. Например, аккумулятор емкостью 100 а-ч желательно заряжать током силой в 10 а в течение 15 час.
http://fazaa.ru/www.youtube.com/watch?v=DuZSNfTNDyg
Серебряно-цинковые аккумуляторы являются новейшими из числа современных аккумуляторов. Электролитом в них служит водный раствор едкого калия КОН с удельным весом 1,4, с активным веществом положительного электрода (окисью серебра Ag20) и отрицательного электрода (цинком Zn). Электроды изготавливаются в виде пористых пластин и отделяются друг от друга пленочной перегородкой.
При разряде аккумулятора окись серебра восстанавливается до металлического серебра, а металлический цинк окисляется до окиси цинка ZnO. Обратный процесс происходит при заряде аккумулятора. Основная химическая реакция выражается формулой
разряд
AgsO + КОН + Zn ?? 2Ag + КОН + ZnO.
заряд
http://fazaa.ru/www.youtube.com/watch?v=0jbnDTRtywE Устойчивое разрядное напряжение составляет около 1,5 В. При небольших токах разряда это напряжение почти не изменяется в течение примерно 75— 80% времени работы аккумулятора. Затем оно довольно быстро падает, и при напряжении 1 в разряд следует прекращать.
Внутреннее сопротивление серебряно-цинковых аккумуляторов существенно меньше, чем остальных щелочных аккумуляторов. При равной емкости первые значительно легче. Они удовлетворительно работают как при пониженной (—50° С), так и при повышенной ( + 75° С) температурах. Наконец, они допускают большие разрядные токи. Например, некоторые типы таких аккумуляторов можно разогреть током короткого замыкания в течение одной минуты.
http://fazaa.ru/www.youtube.com/watch?v=bW_5q7saSR8
Выше изложены только основные сведения по аккумуляторам. При практической работе с аккумуляторами, в особенности со свинцовыми, необходимо тщательно выполнять соответствующие заводские инструкции. Нарушение их вызывает быстрое разрушение аккумуляторов.
Поделитесь полезной статьей:Аккумуляторные батареи: устройство, эксплуатация, принцип работы и схема
Автономные источники электроэнергии являются одними из самых полезных изобретений человечества. Что такое телефон или радио, в которых не установлены аккумуляторные батареи? Устройство многих приспособлений, а также условия их использования не всегда предусматривают наличие постоянного сетевого электропитания, поэтому такие источники электроэнергии позволяют с комфортом осуществлять свою деятельность практически в любой точке мира. После небольшого предисловия давайте приступим к статье.
Что такое аккумуляторная батарея?
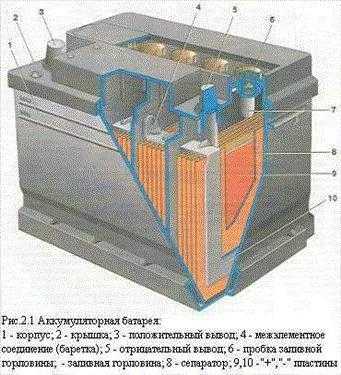 В широком смысле под этим понятием подразумевают устройство, что при одних условиях использования может накапливать какой-либо вид энергии, а при других – расходовать, чтобы удовлетворить нужды человека.
В широком смысле под этим понятием подразумевают устройство, что при одних условиях использования может накапливать какой-либо вид энергии, а при других – расходовать, чтобы удовлетворить нужды человека.
Аккумуляторы аккумулируют электричество от внешнего источника питания, а потом отдают её подключенным потребителям, чтобы они смогли делать свою работу. Так, когда устройства работают, постоянно протекают химические реакции между электролитом и электродными пластинами. Кстати, подобная конструкция размещена в банках, из которых и формируются аккумуляторные батареи. Устройство данных конструкций предусматривает создание напряжения, как правило, 1,2-2 В, что весьма мало. Поэтому для увеличения показателей источников питания и применяются разные типы соединения.
Как работают при разряде аккумуляторные батареи?
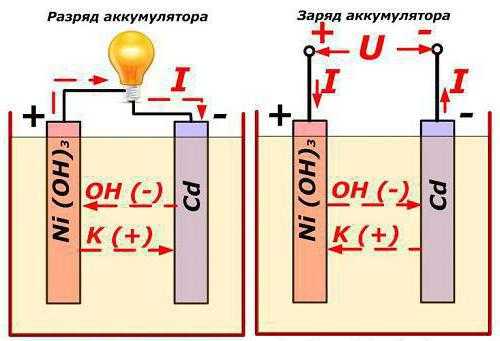
Устройство данных источников питания предусматривает подключение к плюсу и минусу. Функционируют они следующим образом: когда к электродам подключается нагрузка (в качестве примера можно рассмотреть лампочку), то возникает замкнутая электрическая цепь. По ней начинает протекать ток разряда. Формируется он благодаря движению электронов, анионов и катионов. Более детальную информацию о том, что и как протекает, можно рассказать только на конкретном примере.
Допустим, что у нас есть аккумулятор, где положительный электрод – это окись никеля, в который был добавлен графит для повышения проводимости. Для отрицательной пластины применяли губчатый кадмий. Так вот, когда идёт разряд, то частицы активного кислорода выделяются и попадают в электролит. При этом от них отделяются части, которые идут как электричество (те же электроны). Затем частицы активного кислорода направляются в сторону отрицательных пластин, где они окисляют кадмий.
Функционирование аккумулятора при заряде
 Необходимо отключить нагрузку на клеммах пластин. На них же подаётся, как правило, постоянное напряжение (но может быть и пульсирующее, зависит от случая), которое больше, чем величина батареи, что заряжается. Причем полярность должна быть одинаковой. То есть минусовые и плюсовые клеммы потребителя и источника обязаны совпадать. Учтите, что зарядное устройство обязательно должно обладать большей мощностью, чем есть в аккумуляторе, чтобы подавлять остатки энергии в нем и создавать электрический ток, направление которого будет противоположным разряду. В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.
Необходимо отключить нагрузку на клеммах пластин. На них же подаётся, как правило, постоянное напряжение (но может быть и пульсирующее, зависит от случая), которое больше, чем величина батареи, что заряжается. Причем полярность должна быть одинаковой. То есть минусовые и плюсовые клеммы потребителя и источника обязаны совпадать. Учтите, что зарядное устройство обязательно должно обладать большей мощностью, чем есть в аккумуляторе, чтобы подавлять остатки энергии в нем и создавать электрический ток, направление которого будет противоположным разряду. В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.
Давайте рассмотрим пример из предыдущего подпункта статьи. Здесь уже положительный электрод будет обогащаться кислородом, а на отрицательном восстановится чистый кадмий. Подводя итог, можно сказать, что во время заряда и разряда меняется только химический состав электродов. Это не относится к электролиту. Но он может испаряться, что негативно будет сказываться на времени работы батареи.
Итак, мы рассмотрели принцип работы любого аккумулятора. Теперь давайте узнаем, как во время эксплуатации можно улучшить их характеристики.
Параллельное соединение
Величина тока зависит от значительного количества факторов. В первую очередь под этим понимают конструкцию, применяемые материалы и их габариты. Чем большую площадь имеют электроды, тем большие показатели тока они смогут выдержать. Этот принцип используется для параллельного соединения однотипных банок в аккумуляторах. Такое делается, если необходимо увеличить значение тока, что идёт на нагрузку. Но вместе с этим приходится и поднимать мощность источника энергии.
Последовательное соединение
 Если рассматривать банки, из которых состоят аккумуляторные батареи, то необходимо сказать, что они находятся, как правило, в одном корпусе. Подобный тип соединения используется, чтобы получить большие показатели напряжения с меньшими потерями.
Если рассматривать банки, из которых состоят аккумуляторные батареи, то необходимо сказать, что они находятся, как правило, в одном корпусе. Подобный тип соединения используется, чтобы получить большие показатели напряжения с меньшими потерями.
Увидеть применение этой конструкции можно, разобрав автомобильные батареи, которые являются свинцово-кислотными. Стоит сказать, что этот тип применяется не только в устройстве автомобильного аккумулятора, это просто самый вероятный способ разобрать, как же работает подобный тип соединения. В таком случае необходимо позаботится о том, чтобы не было металлического контакта, а существовала надежная гальваническая связь через электролит. Но это только нужно понимать в отношении данного типа. В других случаях по-другому будет реализовываться поставленная задача соединения.
Типы аккумуляторных батарей
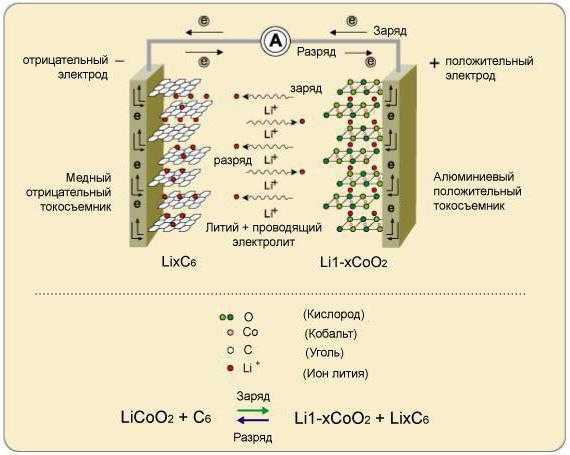 Они разнятся из-за своего предназначения, возможностей, реализации и материала. На данный момент современным производством освоен выпуск больше трех десятков типов, которые отличаются своим составом электродов, а также применяемым электролитом. Так, например, li-ion аккумуляторы могут похвастаться семейством из 12 известных моделей. Условно можно выделить следующие типы:
Они разнятся из-за своего предназначения, возможностей, реализации и материала. На данный момент современным производством освоен выпуск больше трех десятков типов, которые отличаются своим составом электродов, а также применяемым электролитом. Так, например, li-ion аккумуляторы могут похвастаться семейством из 12 известных моделей. Условно можно выделить следующие типы:
- Свинцово-кислотные.
- Литиевые.
- Никель-кадмиевые.
Это самые популярные представители. Но для понимания возможностей предлагаем ознакомиться со списком материалов, которые могут выступать в качестве электродов:
- железо;
- свинец;
- титан;
- литий;
- кадмий;
- кобальт;
- никель;
- цинк;
- ванадий;
- серебро;
- алюминий;
- ряд других элементов, которые, впрочем, встречаются очень редко.
Использование разных материалов влияет на получаемые выходные характеристики и, следовательно, на сферу применения. Так, к примеру, li-ion аккумуляторы применяются в компьютерных и мобильных устройствах. Тогда как никель-кадмиевые используются в качестве замены стандартных гальванических элементов. Теоретически все типы аккумуляторных батарей могут работать с любой нагрузкой. Вопрос только в том, насколько оправданным является такое применение.
 Мы уже рассмотрели, что такое аккумуляторные батареи, устройство этих конструкций, из чего их делают. Теперь давайте сосредоточимся на том, что влияет на их эксплуатацию. Важными для нас характеристиками являются:
Мы уже рассмотрели, что такое аккумуляторные батареи, устройство этих конструкций, из чего их делают. Теперь давайте сосредоточимся на том, что влияет на их эксплуатацию. Важными для нас характеристиками являются:
- Плотностью называют характеристику соотношения количества энергии к объему или весу аккумулятора.
- Емкостью именуют значение максимального заряда аккумулятора, которое он может отдать во время процесса разряда, пока не будет достигнуто наименьшее напряжение. Данный показатель выражается в ампер-часах или кулонах. Также может указываться энергетическая емкость. Она измеряется в ватт-часах или джоулях. Задача такой емкости – сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения.
- Температурный режим оказывает влияние на электрические свойства аккумуляторной батареи. Когда есть серьезные отклонения от рекомендованного производителем диапазона эксплуатации, то существует высокая вероятность выхода источника питания из строя. Это объясняется тем, что холод и жара влияют на интенсивность протекания химических реакций, а также на внутреннее давление.
- Саморазрядом именуют потери емкости, которые происходят после заряда батареи, когда отсутствует нагрузка на клеммах. Во многом этот показатель зависит от конструктивного исполнения и может увеличиваться, если нарушилась изоляция.
Вот такие характеристики аккумуляторных батарей и предоставляют для нас наибольший интерес. Конечно, если придётся делать что-то новое и эксклюзивное, ранее невиданное, то может понадобиться и что-то ещё. Но это весьма маловероятно.
Устройство электродов
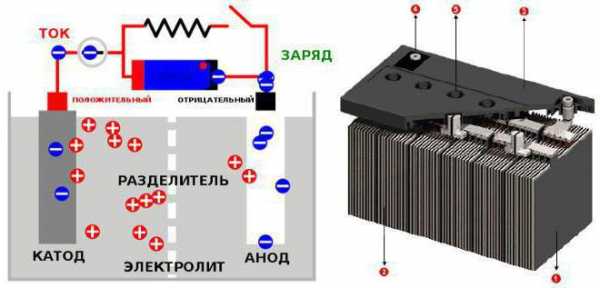 В качестве примера мы возьмём свинцовые пластины. Хотя таковыми они были раньше. Современные пластины изготавливаются из свинцово-кальциевого сплава. Благодаря этому достигается низкий уровень саморазряда батареи (50% емкости теряется за 18 месяцев). Также это позволяет экономно расходовать воду (всего 1 грамм на ампер-час).
В качестве примера мы возьмём свинцовые пластины. Хотя таковыми они были раньше. Современные пластины изготавливаются из свинцово-кальциевого сплава. Благодаря этому достигается низкий уровень саморазряда батареи (50% емкости теряется за 18 месяцев). Также это позволяет экономно расходовать воду (всего 1 грамм на ампер-час).
Можно встретить и гибридную конструкцию, где, кроме свинца, в положительный электрод добавляется сурьма, а в отрицательный – кальций. Правда, в таких случаях имеется повышенный расход воды. Чтобы повысить стойкость к коррозийным процессам, добавляют олово или серебро.
Электроды изготавливаются с решетчатой структурой, их покрывают слоем активной массы. Принцип работы аккумуляторной батареи в немалой степени зависит от того, какой материал используется для пластин. Мы рассматриваем свинцовые, которые просты для изучения, но ориентироваться на них всегда не рекомендуем.
Электролит
Рассматриваем все те же свинцово-кислотные батареи. В качестве электролита, в который они помещаются, чаще всего выступает серная кислота. Она обладает определённой плотностью, которая может меняться в зависимости от уровня заряда батареи. В данном случае действует принцип: чем больше, тем выше. Со временем электролит улетучивается, и емкость аккумуляторной батареи падает. На сроке службы сказываются особенности эксплуатации (соблюдение техники безопасности). В батареях электролит может быть двух типов:
- жидким;
- в виде пропитанного специального материала.
На данный момент наиболее распространён первый тип.
Эксплуатация аккумуляторных батарей
 Использование аккумуляторов можно наблюдать практически везде. Вспомните свои мобильные телефоны или источники бесперебойного питания для компьютеров. В качестве примера можно привести и обычный фонарик (современные образцы всё чаще изготавливаются со встроенным аккумулятором и не рассчитаны на гальванические элементы). А автомобили? Системы «стоп-старт» и рекуперативного торможения работают от аккумуляторов, причем они выдвигают высокие требования к пусковому току, глубокому разряду и долговечности. Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.
Использование аккумуляторов можно наблюдать практически везде. Вспомните свои мобильные телефоны или источники бесперебойного питания для компьютеров. В качестве примера можно привести и обычный фонарик (современные образцы всё чаще изготавливаются со встроенным аккумулятором и не рассчитаны на гальванические элементы). А автомобили? Системы «стоп-старт» и рекуперативного торможения работают от аккумуляторов, причем они выдвигают высокие требования к пусковому току, глубокому разряду и долговечности. Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.
Схема построения аккумуляторной батареи
Мы рассмотрели основную информацию о данных устройствах. Давайте ещё уделим внимание такому понятию, как схема аккумуляторной батареи. Ведь в рамках статьи по нему прошлись только вскользь. Аккумулятор современной схемы, согласно истории, был впервые создан французским физиком Гастоном Плантом. Площадь его творения превышала 10 квадратных метров! Современные батареи, по сути, являются просто значительно уменьшенными и немного доработанными копиями его аккумулятора. Видимым для человека элементом является только корпус. Он обеспечивает общность и целостность конструкции.
Принцип работы аккумулятора
Устройство и механизм работы аккума
Батареи — это хим источники тока с обратимым процессом: они могут отдавать энергию, преобразуя химическую энергию в электронную, либо они могут копить энергию, преобразуя электронную энергию в хим. Таким образом, аккумулятор попеременно то разряжается, отдавая электронную энергию, то заряжается от какого- или соответственного источника неизменного тока
Батареи зависимо от используемого в их электролита подразделяются на кислотные и щелочные. Не считая того, батареи различаются в зависимости от материала электродов; обширное применение имеют только свинцовые, кад- миево-никелевые, железо-никелевые и серебряно-цинковые аккумуляторы.
Устройство и механизм работы аккума
Емкость аккума определяется количеством электричества qp, которое он может дать при разряде в питаемую цепь. Это количество электричества измеряется не в кулонах, а в более больших единицах — ампер-часах (а-ч) 1 а-ч = 3600 к. Но для заряда аккума требуется большее количество электричества q3, чем отдаваемое при разряде. Отношение qp : q3 =ne именуется отдачей аккума по емкости.
Напряжение, нужное для заряда аккума, значительно выше того напряжения на зажимах аккума, при котором он дает продолжительно разрядный ток.
Принципиальной чертой аккума являются его средние зарядное и разрядное напряжения.
Ясно, что из-за ряда утрат энергии аккумулятор дает при разряде существенно наименьшее количество энергии Wp, чем получает при заряде Отношение Wp : W3= n есть коэффициент полезного деяния либо отдача по энергии аккумулятора.
В конце концов, очень принципиальной для свойства аккума величиной является его удельная э н е р г и я, т. е. количество энергии, отдаваемой при разряде, приходящееся на 1 кг веса аккума. В особенности значительно, чтоб удельная энергия была, может быть больше у нестационарных аккумов, устанавливаемых, к примеру, на самолетах. В схожих случаях обычно она важнее, чем коэффициент полезного деяния и отдача по емкости.
Следует подразумевать, что при неспешном разряде процесс в аккуме протекает умеренно во всей массе пластинок, благодаря чему при продолжительном разряде малым током емкость аккумулятора больше, чем при краткосрочном разряде огромным током. При резвом разряде процесс в массе пластинок отстает от процесса на их поверхности, что вызывает внутренние токи и уменьшение отдачи.
Работа авто аккума строится на превращении энергии: при заряде – электронной в хим, при разряде (оборотное перевоплощение) – хим в электронную
Напряжение аккума значительно меняется во время разряда. Лучше, чтоб оно было может быть более постоянным. В расчетах обычно указывается среднее разрядное напряжение Up. Но для заряда аккума нужен источник тока, дающий существенно большее зарядное напряжение Uз (на 25— 40%); в неприятном случае нереально зарядить аккумулятор стопроцентно.
Если напряжение 1-го аккумуляторного элемента недостаточно для данной установки, то нужное число аккумуляторных частей соединяется поочередно. Естественно, последовательно соединять можно только батареи, рассчитанные на одну и ту же разрядную силу тока.
Если разрядный ток 1-го элемента недостаточен, то применяется параллельное соединение нескольких схожих элементов.
Из числа кислотных аккумов практическое значение имеют только свинцовые батареи. В их на положительном электроде активным веществом служит двуокись свинца РЬ02, на отрицательном электроде — губчатый свинец РЬ. Положительные пластинки имеют бурый цвет, отрицательные— сероватый, в качестве электролита применяется раствор серной кислоты h3S04 с с удельным весом 1,18—1,29.
Хим процесс разряда и заряда свинцового аккумулятора относительно сложен. В главном он сводится к восстановлению свинца на положительном электроде и окислению губчатого свинца на отрицательном электроде в закисную соль серной кислоты. При всем этом появляется вода и, как следует, плотность электролита миниатюризируется. При разряде поначалу напряжение аккума стремительно падает до 1,95 в, а потом медлительно снижается до 1,8 в. После этого нужно закончить разряд.
При предстоящем разряде имеет место необратимый процесс образования кристаллического сернокислого свинца PbS04. Последний покрывает пластинки белоснежным налетом. Он обладает большим удельным сопротивлением и практически не растворим в электролите. Слой сернокислого свинца наращивает внутреннее сопротивление активной массы пластинок. Таковой процесс именуется сульфатацией пластинок.
При заряде аккума процесс идет в оборотном направлении: на отрицательном электроде восстанавливается металлический свинец, а на положительном электроде свинец окисляется до двуокиси РЬ02. Ион S04 перебегает в электролит, потому плотность серной кислоты при заряде возрастает, следовательно, растет и удельный вес электролита. Для измерения удельного веса электролита применяется особый ареометр. По его свидетельствам можно приблизительно судить, в какой мере аккумулятор заряжен. Среднее разрядное напряжение свинцового аккума 1,98 в, а среднее зарядное напряжение 2,4 в.
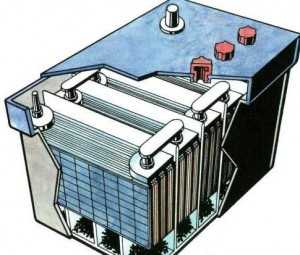
Механизм работы свинцово-кислотного аккума
Внутреннее сопротивление rBн свинцовых аккумов, благодаря малому расстоянию меж пластинами и большой площади их соприкосновения с электролитом очень не достаточно: порядка тысячных толикой ома у стационарных аккумов и сотых долей у маленьких переносных аккумов.
Вследствие малого внутреннего сопротивления и относительно огромного напряжения к. п. д. этих аккумов добивается 70— 80 %, а отдача — 0,85—0,95 %.
Но из-за малого внутреннего сопротивления в свинцовых аккумах при маленьких замыканиях появляются токи очень большой силы, что приводит к короблению и распаду пластинок.
Свинцовые батареи владеют рядом существенных недостатков. Они тяжелы из-за огромного веса свинца пластинок и их объем велик из-за значимого количества электролита, активно участвующего в процессе. В их неизбежен саморазряд внутренними паразитными электронными токами с потерей заряда порядка 1 % в день. В конце концов, они очень чувствительны к толчкам и сотрясениям. Но их отдача и к. п. д. существенно выше, чем у всех других аккумов.
Из числа щелочных аккумов обширное применение в текущее время имеют кадмиево-никелевые, железо- никелевые и серебряно-цинковые. Во всех этих аккумах электролитом служит щелочь — приблизительно двухпроцентный раствор едкого калия КОН либо едкого натра NaOH. При заряде и разряде этот электролит практически не претерпевает конфигураций. Следовательно, от его количества емкость аккума не зависит. Это дает возможность свести к минимуму количество электролита во всех щелочных аккумах и таким методом значительно их облегчить.
Остовы положительной и отрицательной пластинок этих аккумуляторов изготовляются из железных никелированных рамок с пакетами для активной массы. Благодаря таковой конструкции активная масса крепко удерживается в пластинках и не выпадает при толчках.
В кадмиево-никелевом КН аккуме активным веществом положительного электрода служат окислы никеля, смешанные для роста электропроводности с графитом; активным веществом отрицательного электрода является губчатый железный кадмий Cd. При разряде на положительном электроде расходуется часть активного кислорода, содержащегося в окислах никеля, а на отрицательном электроде окисляется железный кадмий. При заряде назад обогащается кислородом положительный электрод — гидрат закиси никеля Ni(OH)2 перебегает в гидрат окиси никеля Ni(OH)3, а на отрицательном электроде гидрат закиси кадмия восстанавливается в незапятнанный кадмий. Приближенно процесс в этом аккумуляторе может быть выражен хим формулой:
разряд
2Ni (ОН)3 + 2КОН + Cd 2Ni (ОН)2 + 2КОН + Cd (ОН)2.
заряд
Как указывает формула, из электролита при разряде выделяется частичка (ОН)2 на отрицательной пластинке и такая же частичка перебегает в электролит на положительной пластинке. При заряде процесс идет в оборотном направлении, но в обоих случаях электролит не меняется.

Батареи компании Bosch
Устройство железо-никелевого аккума отличается только тем, что в нем в отрицательных пластинках кадмий заменен маленьким порошком железа (Fe). Хим процесс этого аккума можно проследить по вышеприведенному для кадмиево-никелевого аккумулятора уравнению методом подмены Cd на Fe.
Применение железа заместо кадмия удешевляет аккумулятор, делает его более крепким механически и наращивает срок его службы. Но с другой стороны, у железо-никелевого аккумулятора при том же приблизительно разрядном напряжении зарядное напряжение на 0,2 в выше, вследствие чего к. п. д. этого аккума ниже, чем кадмиево-никелевого. Потом очень принципиальным недостатком железо-никелевого аккумулятора является относительно резвый саморазряд. У кадмиево-никелевого аккума саморазряд мал и потому ему отдается предпочтение в тех случаях, когда аккумулятор должен продолжительно находиться в заряженном состоянии, к примеру, для питания радиоустановок. Среднее разрядное напряжение обоих этих аккумов 1,2 в.
Герметически закрытые сосуды вышеперечисленных щелочных аккумов производятся из листовой никелированной стали. Болты, через которые пластины аккумов соединяются с наружной целью, пропускаются через отверстия в крышке сосуда, при этом болт, с которым соединены отрицательные пластины, кропотливо изолирован от железного корпуса; но болт, соединенный с положительными пластинами, от корпуса не изолируется.
Внутреннее сопротивление щелочных аккумов значительно больше, чем кислотных, благодаря этому они лучше переносят недлинные замыкания. Но по той же причине к. п. д. щелочных аккумов (порядка 45%) существенно ниже, чем кислотных, также значительно меньше их удельная энергия и отдача по емкости (0,65). Потому что состояние электролита у щелочных аккумов при работе не меняется, то найти их степень заряженно- сти по наружным признакам нельзя. Вследствие чего за зарядом приходится смотреть на основании их емкости и напряжения. При заряде необходимо сказать аккуму количество электричества It=q существенно большее, чем его емкость, приблизительно в 1,5 раза. К примеру, аккумулятор емкостью 100 а-ч лучше заряжать током силой в 10 а в течение 15 час.
Серебряно-цинковые СЦ батареи являются новейшими из числа современных аккумов. Электролитом в их служит водный раствор едкого кали КОН с удельным весом 1,4, активным веществом положительного электрода — окись серебра Ag20, а отрицательного электрода — цинк Zn. Электроды изготовляются в виде пористых пластинок и отделяются друг от друга пленочной перегородкой.

Батареи компании Varta
При разряде аккума окись серебра восстанавливается до металлического серебра, а железный цинк окисляется до окиси цинка ZnO. Обратный процесс происходит при заряде аккума. Основная хим реакция выражается формулой
разряд
AgsO + КОН + Zn 2Ag + КОН + ZnO.
заряд
Устойчивое разрядное напряжение составляет около 1,5 в. При маленьких токах разряда это напряжение практически не меняется в течение приблизительно 75— 80% времени работы аккума. Потом оно достаточно быстро падает и при напряжении 1 в разряд следует прекращать.
Внутреннее сопротивление серебряно-цинковых аккумов существенно меньше, чем других щелочных аккумов. При равной емкости 1-ые существенно легче. Они удовлетворительно работают как при пониженной (—50° С), так и при завышенной ( + 75° С) температурах. В конце концов, они допускают огромные разрядные токи. К примеру, некие типы таких аккумуляторов можно разогреть током недлинного замыкания в течение одной минутки.
Выше изложены только главные сведения по аккумуляторам. При практической работе с аккумуляторами, в особенности со свинцовыми, нужно кропотливо делать надлежащие заводские аннотации. Нарушение их вызывает быстрое разрушение аккумов.
"Питер - АТ"
ИНН 780703320484
ОГРНИП 313784720500453











